תאוריית לואיס
בתקופה בין השנים 1916-1919, שני אמריקאים, גילברט ניוטון לואיס ואירווינג לאנגמיור פיתחו מודל, שנקרא מודל לואיס. ממודל זה התפתחה תאורית לואיס, והיא בין השאר טוענת את הדברים הבאים:
- אלקטרונים, בייחוד אלקטרוני הערכיות, משחקים תפקיד מאוד חשוב בקשרים הכימיים.
- בחלק מן המקרים, אלקטרונים עוברים מאטום אחד לאטום אחד. יונים חיוביים ושליליים נוצרים וכתוצאה מכך שני היונים נמשכים אחד לשני ע”י כוחות אלקטרוסטטיים שנקראים קשרים יוניים.
- ישנם מקרים בהם אלקטרונים משותפים לשני אטומים שונים. קשר שנוצר ע”י שיתוף האלקטרונים נקרא קשר קוולנטי.
- אלקטרונים עוברים או משותפים בצורה כזאת שכל אטום מוצא את עצמו בקונפיגורציה אלקטרונים יציבה. לרוב זה בא לידי ביטוי כקונפיגורציה אלקטרונית של גז אציל, עם
אלקטרונים ערכיים (חיצוניים) אשר נקראים אוקטט.
סימן ומבנה לואיס
לואיס פיתח סימנים לתאוריה שלו. סימן לואיס מורכב מסימן כימי כדי לייצג גרעין ואת אלקטרוני הליבה שלו (אלקטרוני המיסוך, הפנימיים), ביחד עם נקודות מסביב לסימן כדי לייצג את אלקטרוני הערכיות שלו. למשל, סימן לואיס עבור סיליקון (
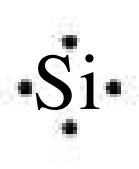
מבנה לואיס הוא קומבינציה של סימני לואיס שמתארת העברה או שיתוף של אלקטרונים בקשר כימי. למשל, עבור קשר קוולנטי (שיתוף אלקטרונים):
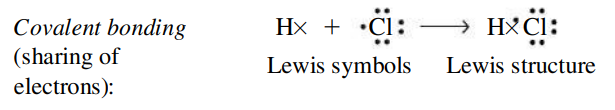
קשר יוני וקשר קוולנטי
קשר יוני
אחת מהדרכים להגיע לקונפיגורציה של גז אציל היא ע”י העברת אלקטרונים בין אטומים.
קשר יוני נוצר כאשר אלקטרון עובר מקליפת הערכיות של אטום אחד (יצירת קטיון), לזו של אטום אחר (יצירת אניון). בין היונים הנוצרים כתואה מכך, מתקיימית משיכה אלקטרוסטטית המובילה ליצירת סריג יוני. כדוגמא אפשר להסתכל על מולקולת נתרן-כלורי (מלח בישול, .
![[Technion/GCH1/GCH1_008/Untitled 2.png|האלקטרונים של הנתרן מסומנים עם (x|[x|book]]
האלקטרונים של הנתרן מסומנים עם (x), ואילו של הכלור מנוסמנים עם (⋅).
בקשר יוני משתתפים יסוד בעל אנרגיית יינון נמוכה יחסית (מתכת), אשר יוצר את הקטיון, ויסוד עם זיקה אלקטרונית גבוהה יחסית (אל-מתכת), אשר יוצר את האניון וזאת על מנת שהתהליך כולו “ישתלם” אנרגטית.
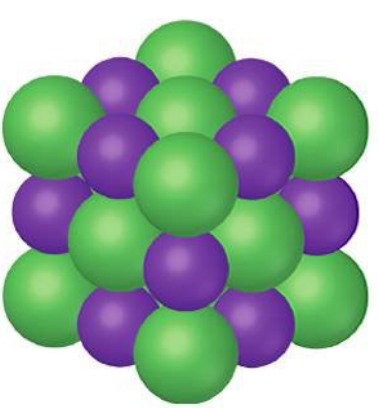
סריג יוני
סריג יוני הוא מארג המכיל מספר רב של אניונים וקטיונים, למשל, עבור מלח בישול:
קשר קוולנטי
אטום כלור (
ניתן להסביר זאת ע”י קשר קוולנטי - קשר כימי בו הלאקטרונים משותפים לשני האטומים:
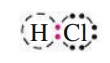
לאלקטרון המימן (
בכתיבת מבנה לואיס נהוג לצייר קו במקום שתי נקודות כאשר רוצים לייצג זוגות אלקטרונים קושרים:
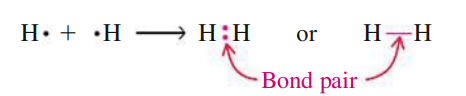
אם זוג האלקטרונים לא קושרים נקרא להם זוג גלמוד, ונסמנם ע”י נקודות כרגיל:
.jpg)
קשר קוולנטי קואורדינטיבי
קשר קוולנטי קואורדינטיבי הוא קשר הנוצר ע”י תרומה של שני אלקטרונים מאטום אחד. דוגמה לכך היא מצב בו אנו מנסים להוסיף אטום
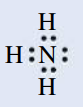
אם אכן נוסיף עוד אטום מימן, מספר אלקטרוני הערכיות מסביב ל-
היון
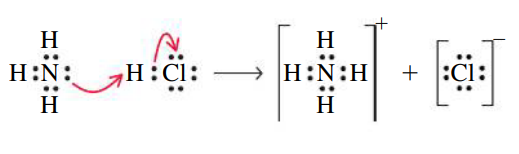
נשים לב כי לאחר שהקשר הקואורדינטיבי נוצר, כל אטומי המימן קשורים באופן זהה לאטום החנקן - לא ניתן להבדיל בינהם. לכן, לא ניתן לדעת מי מארבעת אטומי המימן יותר את הקשר הקואורדינטיבי עם אטום החנקן.
קשרים קוולנטים פולארים
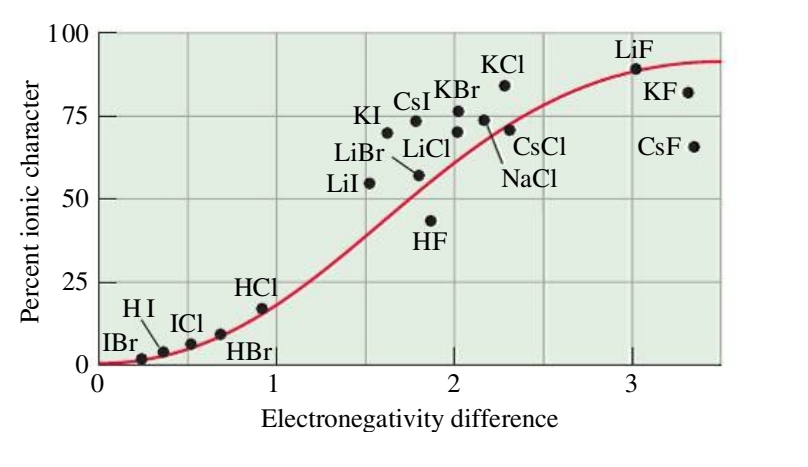
רוב הקשרים הכימיים לא 100% קשרים יוניים או 100% קשרים קוולנטים. הם לרוב ממוקמים בין שני קצוות: קשר יוני אידיאלי בקצה אחד וקשר קוולנטי טהור בקצה השני.
קשר קוולנטי בו אלקטרונים לא משותפים בצורה שווה בין שני האטומים נקרא קשר קוולנטי פולארי. בקשר זה אלקטרונים ממוקמים יותר באזור האטום האל-מתכתי. השיתוף הלא שווה גורם למטען חלקי שלילי (
למשל, במולקולת
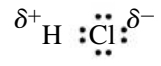
כדי להדגיש את הפולאריות של המטען האלקטרוני, ניתן להציג מולקולות בעזרת מפה אלקטרוסטטית פוטנציאלית, שחושבה ע”י מחשבים בעזרת משוואת שרדינגר עבור מולקולות:
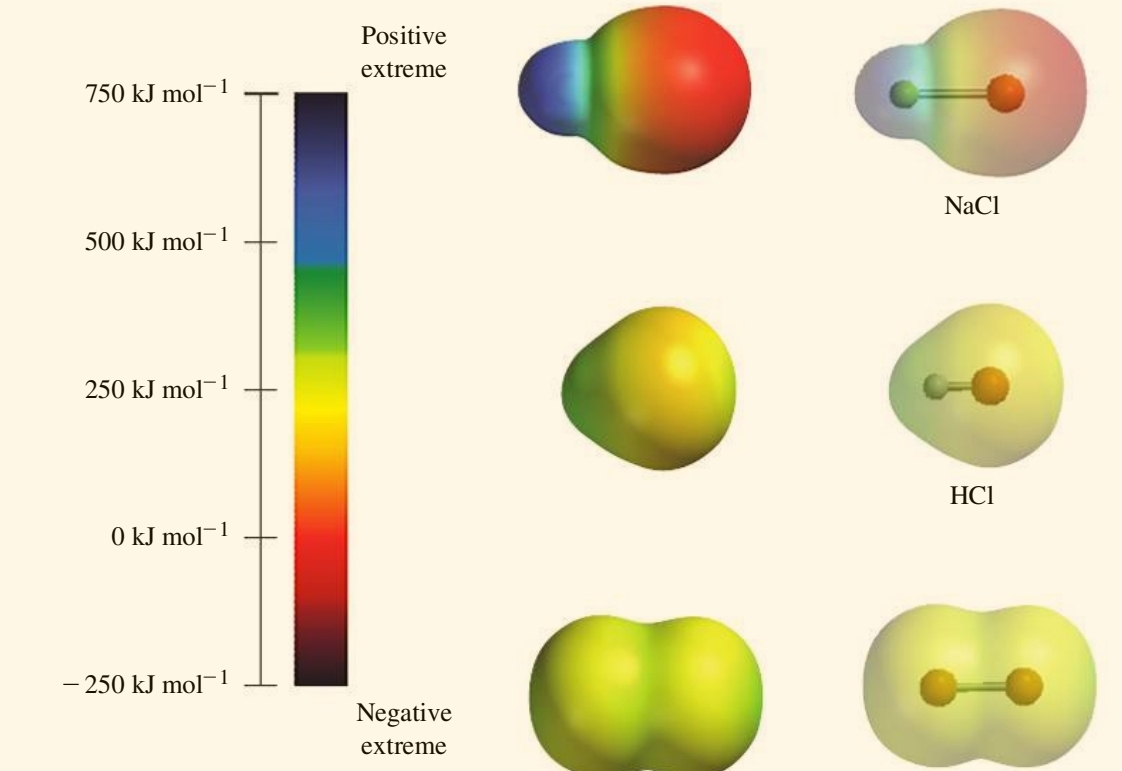
המפה האלקטרוסטטית פוטנציאלית של מולקולות שונות.
כפי שניתן לראות במפה זו, עבור קשר יוני,
עבור הקשר הקוולנטי פולארי,
עבור הקשר הקוולנטי טהור,
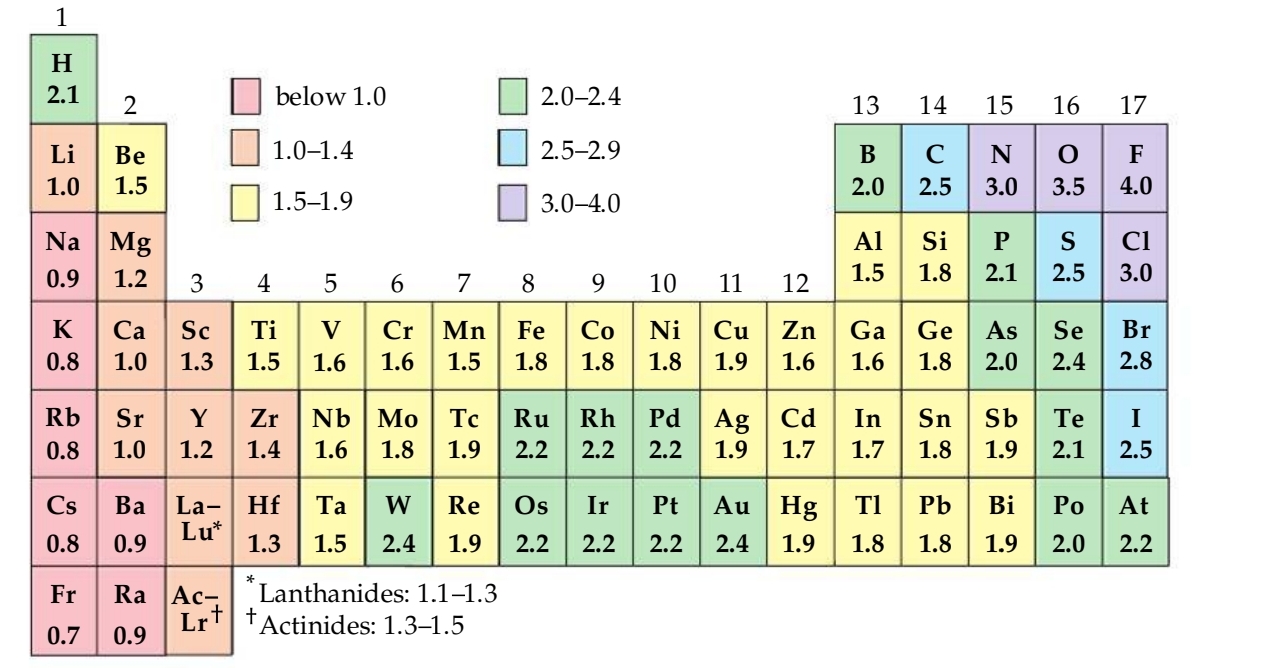
אלקטרושליליות
אלקטרושליליות (
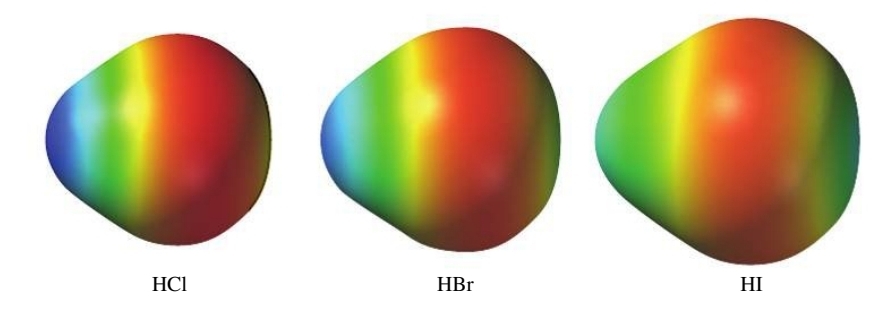
אכן מתקיים כי
האלקטרושליליות פרופורציונית להפרש בין אנרגיית היינון (
עבור מולקולות שונות, נוכל לצייר את הפרש האלקטרומגנטיות שלהן (
כתיבת מבנה לואיס
נזכיר כמה מהמאפיינים של מבנה לואיס:
- כל האלרקטרונים הערכיים של אטומים במבנה לואיס חייבים להופיע במבנה.
- לרוב, כלל האלקטרונים במבנה לואיס קושרים.
- לרוב, כל אטום מתמלא לקליפה חיצונית של 8 אלקטרונים. מימן לעומת זאת, מוגבל ל-2 אלקטרוני ערכיות.
- לפעמים, מספר קשרים קוולנטיים (כפולים או משולשים) חייבים להתקיים. קשרים קוולנטיים רבים לרוב נוצרים ע”י האטומים
.
מבנה שלד
לרוב מתחילים בכתיבת מבנה לואיס עם השלד - כל האטומים מסדורים במבנה לפי הסדר בו הם קושרו אחד לשני. במבנים בעלי יותר משני אטומים נבדיל בין שני אטומים:
- אטום מרכזי - אטום שמקושר לשניים או יותר אטומים.
- אטום טרמינלי - אטום שמקושר רק לאטום אחד.
למשל, מולקולת אתנול, (
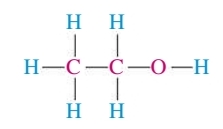
האטומים האדומים הם המרכזיים, הכחולים הם החיצוניים.
הערות:
- אטומי מימן תמיד יהיו אטומים טרמינלים (כיוון שהם יכולים להכיל עד 2 אלקטרוני ערכיות).
- אטומים מרכזיים לרוב הם אלה בעלי האלקטרושליליות הנמוכה ביותר.
- אטומי פחמן תמיד יהיו אטומים מרכזיים.
- מולקולות ויונים חד-אטומיים לרוב בעלי מבנה סימטרי קומפקטי. למשל:
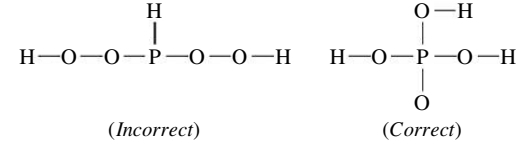
אסטרטגיה לכתיבת מבנה לואיס
- חישוב מספר אלקטרוני הערכיות הכולל.
עבור מולקולת, ישנם אלקטרוני ערכיות לכל אטום , ו- לאטום . בסה”כ: - נזהה את האטומים המרכזיים והטרמינלים.
בדוגמה שלנו, האטומים המרכזיים הם אטומיוהאטומים הטרמינלים הם אטומי . - נשרטט מבנה שלד אפשרי, ונחבר את האטומים במבנה השלד בעזרת קשרים קוולנטיים יחידים.
בדוגמה שלנו: - עבור כל קשר במבנה השלד, נחסר
ממספר אלקטרוני הערכיות. בדוגמה שלנו, נשארו 12 אלקטרוני ערכיות. - עבור כל אלקטרוני הערכיות שנשארו, נמלא אוקטט לאטומים הטרמינלים ואז, אם אפשר, נמלא אוקטט לאטומים המרכזיים. אם מספר אלקטרוני הערכיות הספיק בדיוק, אז סיימנו לשרטט את המבנה לואיס.
בדוגמה שלנו:
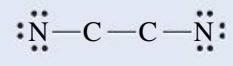
- אם אטום מרכזי נשאר עם אוקטט לא מלא, נזיז אלקטרון בודד מאחד או יותר מהאטומים הטרמינלים, כד ליצור קשר קוולנטי כפול או משולש. נחזור על שלב זה עד שכלל האטומים בעלי אוקטט מלא.
בדוגמה שלנו, אין מספיק אלקטרונים כדי למלא אוקטט לאטומי, לכן ניצור קשר קוולנטי משולש ונעביר אלקטרוני ערכיות מ- ל- :

מטען פורמלי
אם נכתוב את מבנה לואיס עבור היון
- סימטרית:
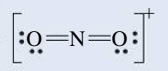
- לא סימטרית:
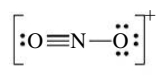
איך נדע באיזה מבנה המולקולה מעדיפה להיות? נוכל לדעת זאת ע”י חישוב המטען הפורמלי של כל אטום.
מטען פורמלי (
נחשב את המטען הפורמלי עבור המבנה הלא סימטרי שלנו של היון

ניתן גם להראות זאת ע”י מספר מעוקף בעיגול במבנה לואיס:
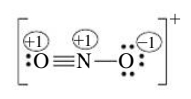
הכללים הבאים יכולים לעזור לנו בהחלטה האם המבנה הלואיס שקיבלנו אפשרי, בהתבסס על המטען הפורמלי שלו:
- סכום כלל המטענים הפורמלים חייב להיות שווה למטען המולקולה כולה.
- מטענים פורמליים צריכים להיות קטנים ככל האפשר.
- מטענים פורמלים שליליים לרוב יופיעו על רוב האטומים בעלי אלקטרושליליות גבוהה. מטענים פורמליים חיוביים לרוב יופיעו על אטומים בעלי אלקטרושליליות נמוכה.
- מבנים בעלי מטענים פורמליים בעלי אותו סימן על אטומים צמודים בעלי סבירות נמוכה.
נשים לב כי בדוגמתנו הלא סימטרית עבור היון
שאלה:
שאלה: האם מטענים פורמלים מייצגים מטענים על האטומים?
תשובה: לא. השיטה של ייחוס אטום למטען פורמלי נועדה לעזור לנו להבין אם מבנה לואיס כלשהו אפשרי. ניתן לחשוב על מטען פורמלי כהמטען של האטום לו האלקטרונים הקושרים בכל קשר היו מחולקים בצורה שווה בין שני האטומים.
יוצאי דופן לכלל האוקטט
ישנם יוצאי דופן לכלל האוקטט:
אוקטט לא מלא
כאשר ננסה לכתוב מבנה לואיס עבור המולקולה
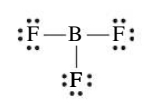
לרוב אלה תהיינה תרכובות של
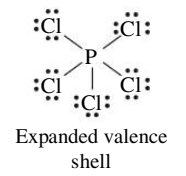
אוקטט מורחב
ישנם מספר מבני לואיס ששוברים את כלל האוקטט ע”י כך שהם בעלי
מספר אלקטרונים אי זוגי
אם מספר אלקטרוני הערכיות במבנה לואיס הוא אי זוגי, חייב להיות אלקטרון לא מקושר איפשהו במבנה. תאורית לואיס מתעסקת עם זוגות אלקטרונים קושרים, ולא אומרת לנו איפה לשים את האלקטרון הלא מקושר. למשל, עבור המולקולת
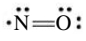
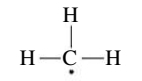
מספר המולקלות היציבות עם מספר אי זוגי של אלקטרונים הוא די מוגבל. יותר שכיחים הינם הרדיקלים החופשיים, או בקיצור הרדיקלים - חלקי מולקולות עם אלקטרון לא מקושר אחד או יותר. סימון רדיקלים לרוב נכתב עם נקודה כדי להדגיש את הקיום של אלקטרון לא מקושר. למשל, הרדיקל
אנתלפיית קשר
כאשר שני אטומים שונים מתחברים כדי ליצור קשר קוולנטי, אנרגיה משתחררת. באותו אופן, אנרגיה נבלעת כאשר מפרידים קשר קוולנטי. אנתלפיית קשר (
שבירת קשר:
היווצרות קשר:
לכל קשר במולקולה נתונה ישנה אנתלפיית קשר משלה, הנקבעת בהתאם לסביבתו הכימית. למרות זאת, נהוג להגדיר אנרגיות קשר ממוצעות כדי להעריך את אנרגיית התגובה.
כדי לחשב את שינוי האנתפליה בתגובה כימית ניתן להיעזר באנתפליות קשר של כל קשר שנוצר ונשבר במהלך התגובה.
כאשר
דוגמה:
נחשב את אנתלפיית התגובה מאנתלפיות הקשר עבור התגובה:
כדי לזהות איזה קשרים נשברו ואיזה נוצרו, נצייר מבנה לואיס עבור כל אחד מהמולקולות.
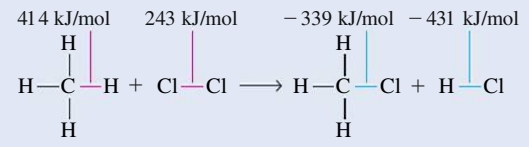
קשרים שלא השתנו צבועים בשחור. קשרים באדום הינם קשרים שנשברו, ואילו קשרים בכחול הם קשרים שנוצרו.
קיבלנו כי בסה”כ נשבור קשר אחד של
ניעזר בטבלה ובנוסחה ונקבל: