הטבלה המחזורית
בערך בשנת 1920, נילס בוהר, החל לקשר בין הקונפיגורציה האלקטרונית של יסודות לטבלה המחזורית. הוא שם לב כי יסודות באותה קבוצה בטבלה המחזורית בעלי קונפיגורציה אלקטרונית דומה.
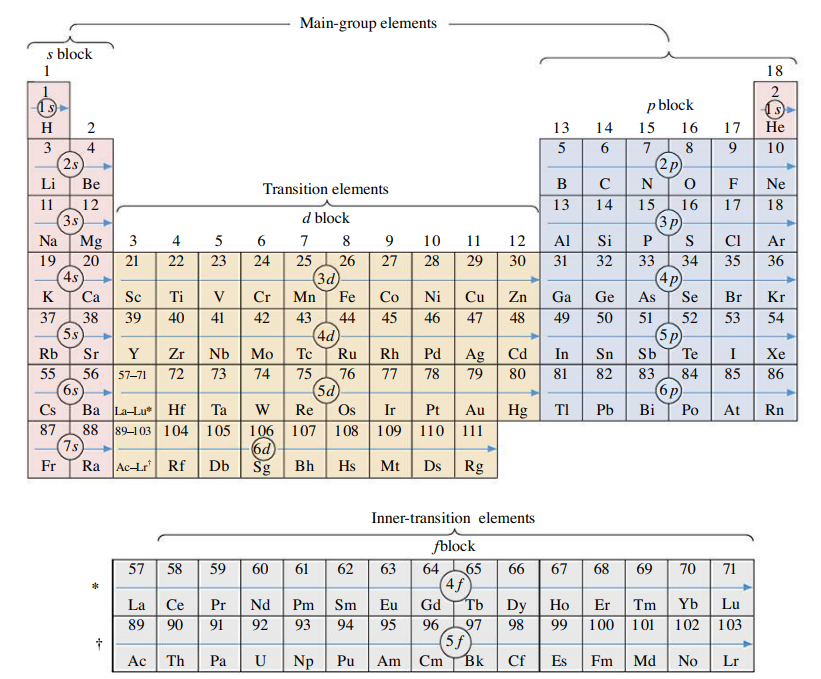
לשורות בטבלה אנו קוראים מחזורים, ולעמודות בטבלה אנו קוראים קבוצות.
גזים אצילים
ליסודות בעלי קליפה
דוגמאות לגזים אצילים:
- הליום
- - ניאון
- - ארגון
-
יסודות בגוש ה-
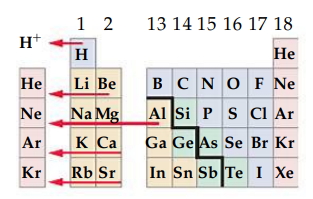
רדיוס אטומי
קשה להגדיר רדיוס אטומי. ידוע שככל שמתרחקים מהגרעין, הסיכוי למצוא אלקטרון קטן. אבל בשום מקום הסתברות זו יורדת לאפס. כלומר, אין גבול מדויק לאטום. ניתן להגדיר רדיוס אטומי אפקטיבי שהוא המרחק מהרדיוס בו
אבל, אנו יכולים למדוד רק את המרחק בין שני גרעינים שכנים. למרות שמרחק מדיד זה משתנה בין אם האטומים מקושרים כימית או רק נוגעים אחד בשני ללא יצירת קשר כימי, אנו נגדיר את הרדיוס כמרחק זה - מרחק בין גרעיני.
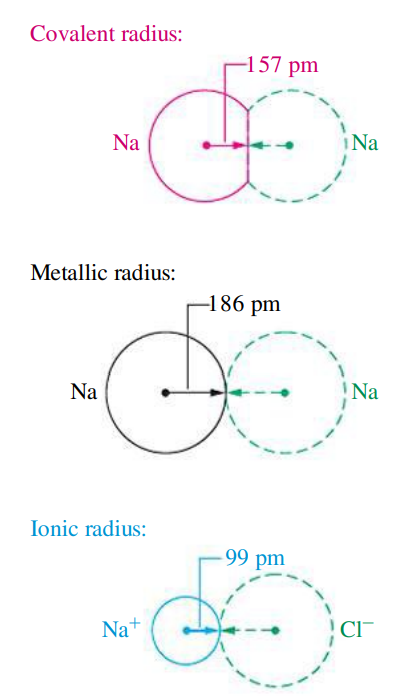
עבור קשרים כימיים שונים, יש ליסוד רדיוסים אטומיים שונים.
עבור כל עמודה בטבלה, במורדה, ככל ש-
עבור כל שורה בטבלה, האלקטרונים מתווספים לאותה קליפה (אותו ה-
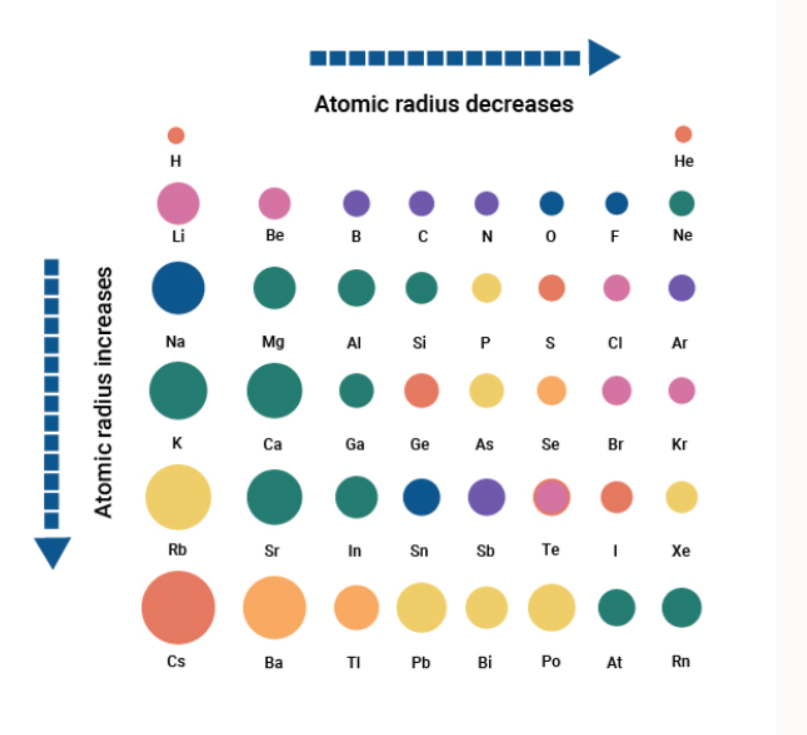
אם נצייר את גרף של רדיוס האטום מול המספר האטומי שלו, נקבל:
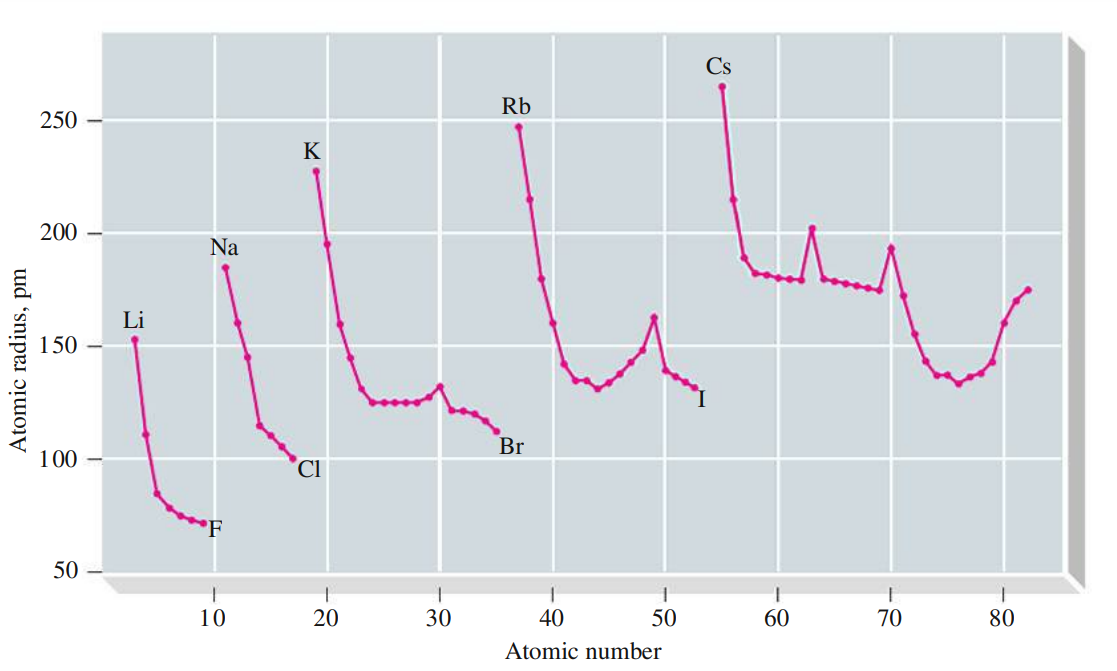
מה גורם לקפיצות הקטנות האלו? אין לי שמץ, זה לא בחומר.
אנרגיית יינון
אנרגיית יינון (
בנוסף, אנרגיית יינון ראשונה (
אנרגיית יינון שנייה (
ככל שרדיוס האטום גדל, אנרגיית היינון קטנה.
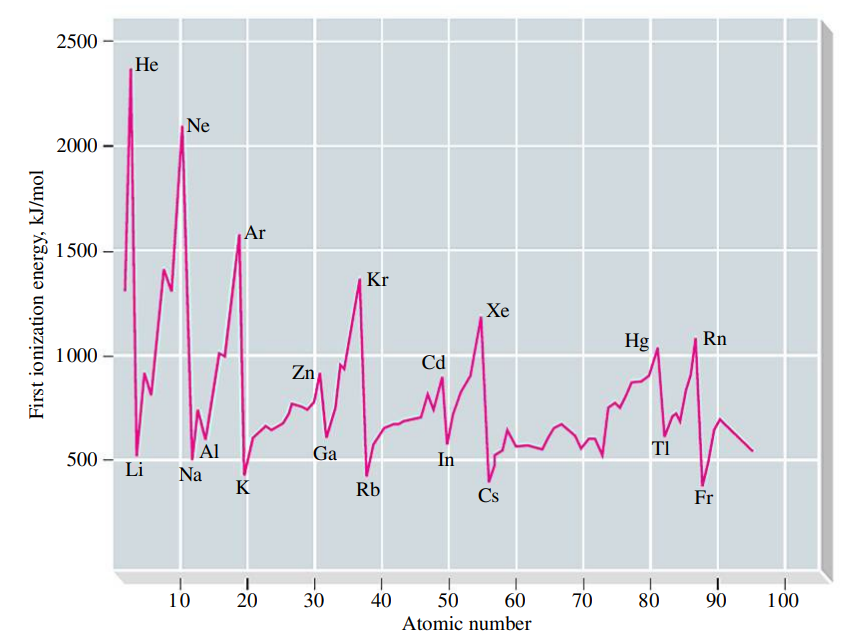
כיוון שהם כה יציבים, יותר אנרגיה דרושה ליינן גזים אצילים מאשר יסודות שבאים מייד אחריהם.
כל אנרגיית יינון היא גדולה בהרבה מהאנרגיית יינון הקודמת לה. למשל, עבור מגנזיום (
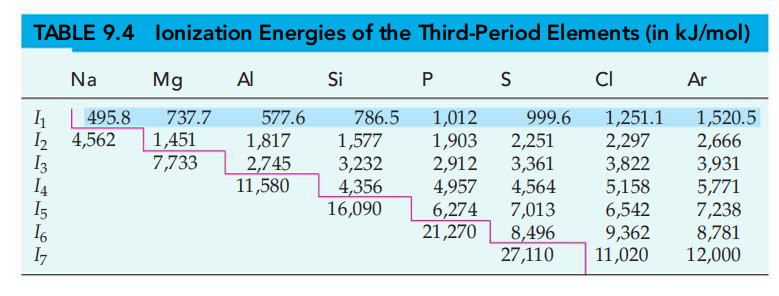
ניתן לראות קפיצה משמעותית באנרגיית היינון ברגע שיסוד התיינן עד לקונפיגורציה אלקטרונית דמוית גז אציל - יינון של אטום זה ידרוש הרבה יותר אנרגיה בשל יציבות קונפיגורציה זו.
אם נביט בטבלה ובגרף נשים לב כי ישנם יוצאי דופן בנטייה של אנרגיות יינון לגדול עם הקטנת הרדיוס האטומי:
-
מגנזיום ואלומיניום: ציפינו כי
של להיות גדולה מזו של . ההפך מתקיים כי מאבד אלקטרון מ- . עם זאת, מאבד אלקטרון מ- :
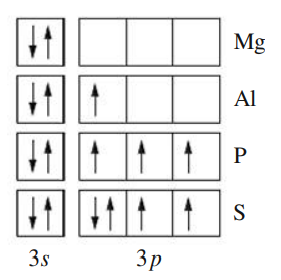
לתת-קליפהרמת אנרגיה נמוכה מזו של התת קליפה . לכן נצפה שיידרש יותר אנרגיה להוציא אלקטרון מאורביטל (ככל שהאנרגיה של האלקטרון נמוכה יותר, כך קשה יותר להוציא אותו). -
זרחן וגופרית: לזרחן (
) תת קליפה חצי מלאה ( ), ואילו לגופרית ( ) אלקטרון אחד נוסף ( ). אצל גופרית, ישנה דחייה קטנה בין שני האלקטרונים ב- שבאותו אורביטל, מה שמאפשר יינון יותר “קל” של גופרית מאשר זרחן.
זיקה אלקטרונית
****************זיקה אלקטרונית (
למשל, המשוואה התרמוכימית להוספת אלקטרון לאטום פלואור (
נשים לב כי תהליך זה הוא אקסותרמי, כלומר, אנרגיה משתחררת כאשר אטום
ניתן גם לחשוב על זיקה אלקטרונית כהנטיה לאטום ניטרלי לקבל אלקטרון.
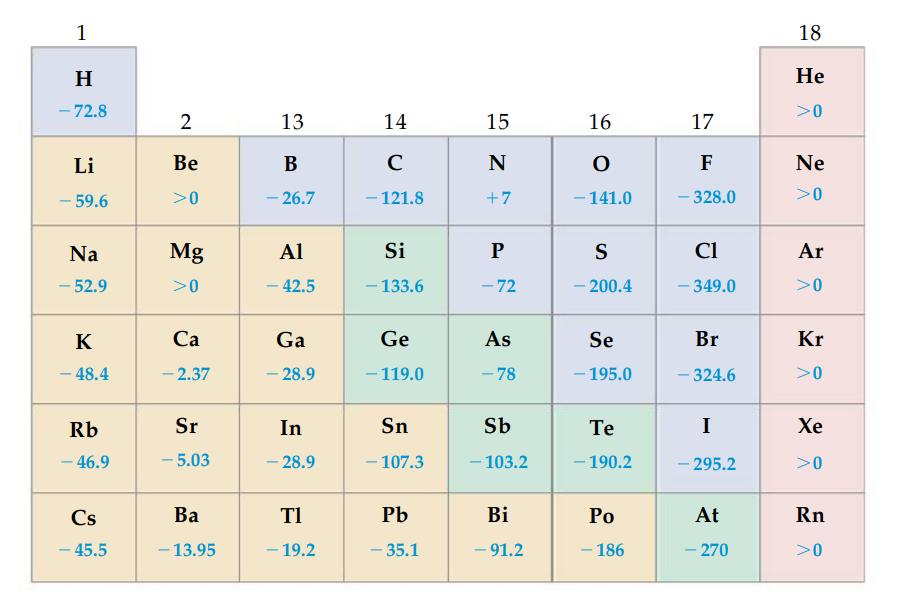
הזיקה האלקטרונית של יסודות שונים.
נשים לב כי לאלקטרונים בטור ה-7 (או 17), ישנה זיקה אלקטרונית “חזקה”, שמתבטאת בערכי
כאשר מדובר על הוספת אלקטרון שני לאטום אל-מתכתי, נראה זיקה אלקטרונית חיובית. האלקטרון השני שמתווסף, מצטרף לאטום שהוא כבר לא ניטרלי, אלא שלילי. ישנו כוח דחייה חזק בין היון (האטום השלילי) לאלקטרון שמתווסף, ולכן כתוצאה האנרגיה של המערכת גדלה (היא כעת פחות יציבה).
אז למשל, עבור חמצן (
כלומר, היון הגזי