גבול המסיסות, פאזות
גבול מסיסות
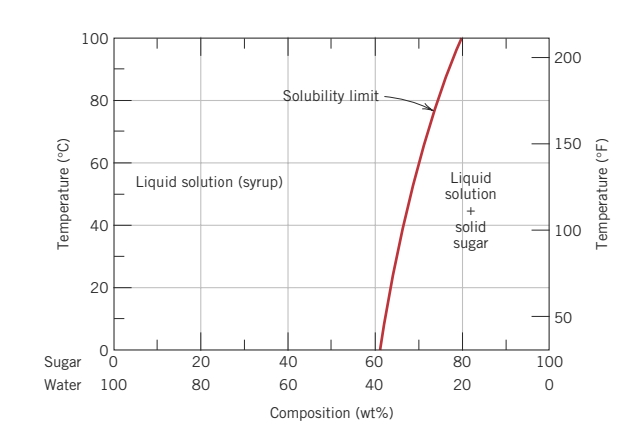
לתמיסות רבות בטמפרטורה מסוימת, יש גבול מסוים לריכוז האטומים שמוססים בחומר הממס. גבול זה נקרא גבול המסיסות. הוספה של מומס מעבר לגבול זה תגרום להיווצרות של תמיסה מוצקית או תרכובת בעלת הרכב שונה.
למשל, ניקח דוגמה של סוכר במים (
כעת, המערכת מכילה שני חומרים שונים - תמיסת סוכר-מים נוזילת, וגבישי מלח מוצקים.
גבול המסיסות של סוכר במים תלויה על הטמפרטורה של מים וניתן להציג אותה בצורה גרפית - דיאגרמת פאזות:
פאזה
פאזה מוגדרת כחלק הומוגני של מערכת בעלת מאפיינים פיזיקליים וכימיים אחידה. כל חומר טהור נחשב פאזה. למשל, תמיסת סוכר-מים היא גם פאזה אחת, וגביש המלח הוא פאזה אחרת - לכל אחד מאפיינים שונים.
כאשר במערכת יש פאזה יחידה, אומרים שהיא הומוגנית (לא ממ”ל הומוגנית, לא מד”ר הומוגנית, לא מד”ר מטיפוס הומוגני). כאשר יש יותר מפאזה יחידה, נאמר כי המערכת הטרוגנית. רוב הסגסוגות המתכתיות, החומרים הקרמיים והפולימרים הם הטרוגנים.
דיאגרמת פאזות בינארית
דיאגרמת פאזות כפי שהוצג במבוא לכימיה, היא גרף המתאר את הפאזה של מערכת מסוימת תחת נתונים שונים כמו טמפרטורה, לחץ או ריכוז.
דיאגרמת פאזות בינארית היא סוג של דיאגרמת פאזות המתארת את הפאזות של שני חומרים שונים בערבוב, תחת טמפרטורות שונות, ולחץ קבוע, לרוב
בנושאים הבאים, נעסוק בהתחלה בדיאגרמת פאזות בשיווי משקל. לחומרים לוקח זמן לעבור מפאזה אחת לפאזה אחרת. לאחר זמן רב (
ניקח לדוגמה את דיאגרמת הפאזות של נחושת-ניקל:
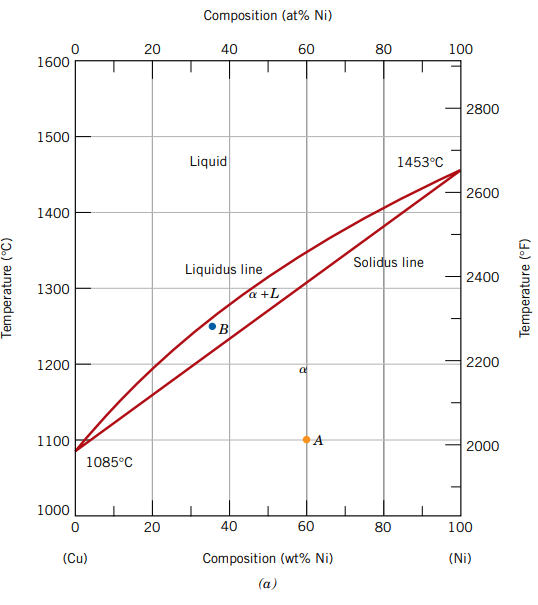
בציר האנכי הטמפרטורה, ובציר האופקי אחוז הניקל בסגסוגת (במשקל). נשים לב כי מתוארים לנו 3 אזורים:
- אזור
- פאזה מוצקה של ניקל ונחושת בעלי מבנה FCC. בטמפרטורות מתחת ל- , נחושת וניקל מוססים אחד בשני בפאזה המוצקה שלהם. ניתן להסביר את המסיסות הזאת ע”י כך שגם לנחושת וגם לניקל יש את אותו מבנה FCC, רדיוס אטומי ואלקטרושליליות כמעט זהים. לכן, מערכת זו היא איזומורפית - כאשר שני חומרים מוססים אחד בשני גם בפאזה מוצקה וגם בפאזה נוזלית.
2.אזור- אזור דו-פאזי - גם מוצק וגם נוזל. - אזור
- פאזה נוזלית הומוגנית של נחושת וניקל.
לקו המפריד בין
דיאגרמת פאזות במסיסות מלאה
בנקודה
אבל, בנקודה
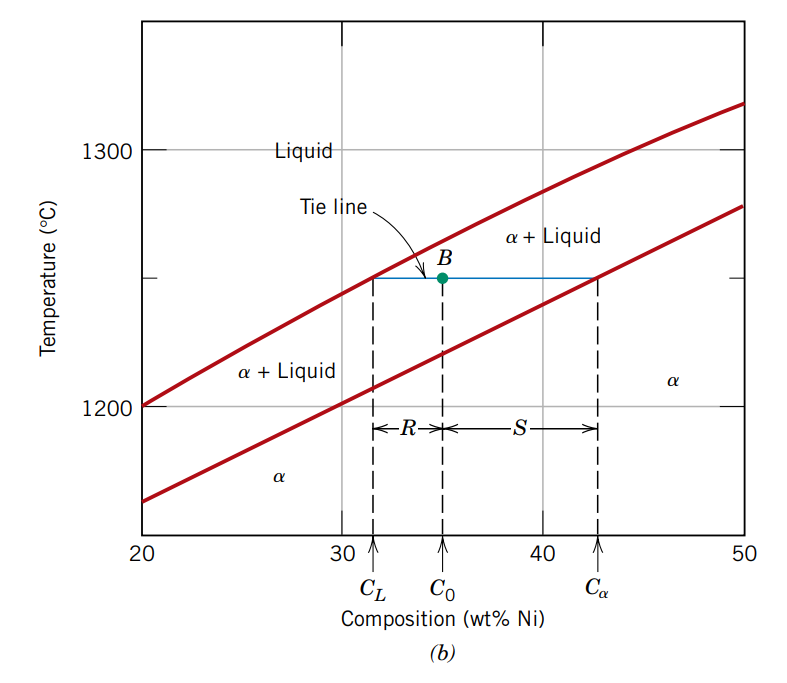
נשרטט קו אופקי בנקודה, שנקרא איזותרמה, שחוצה את הסולידוס והליקווידוס. נקודת המפגש של האיזותרמה עם הסולידוס ייצג את הרכב המוצק
את כמות הפאזה באזור הדו-פאזי גם טיפה יותר קשה לחשב מאשר החישוב הטריוויאלי באזור חד-פאזי (יש פאזה אחת, אז כמות הפאזה היא
אם נביט בגרף, נשים לב כי הנקודה
נוסחה:
באותו אופן עבור הפאזה
נוסחה:
כיוון שהם יחסים, נסיק כי
דיאגרמת פאזות במסיסות חלקית
דיאגרמת מסיסות מלאה מראה על קיום פאזה יחידה שבה מרכיב
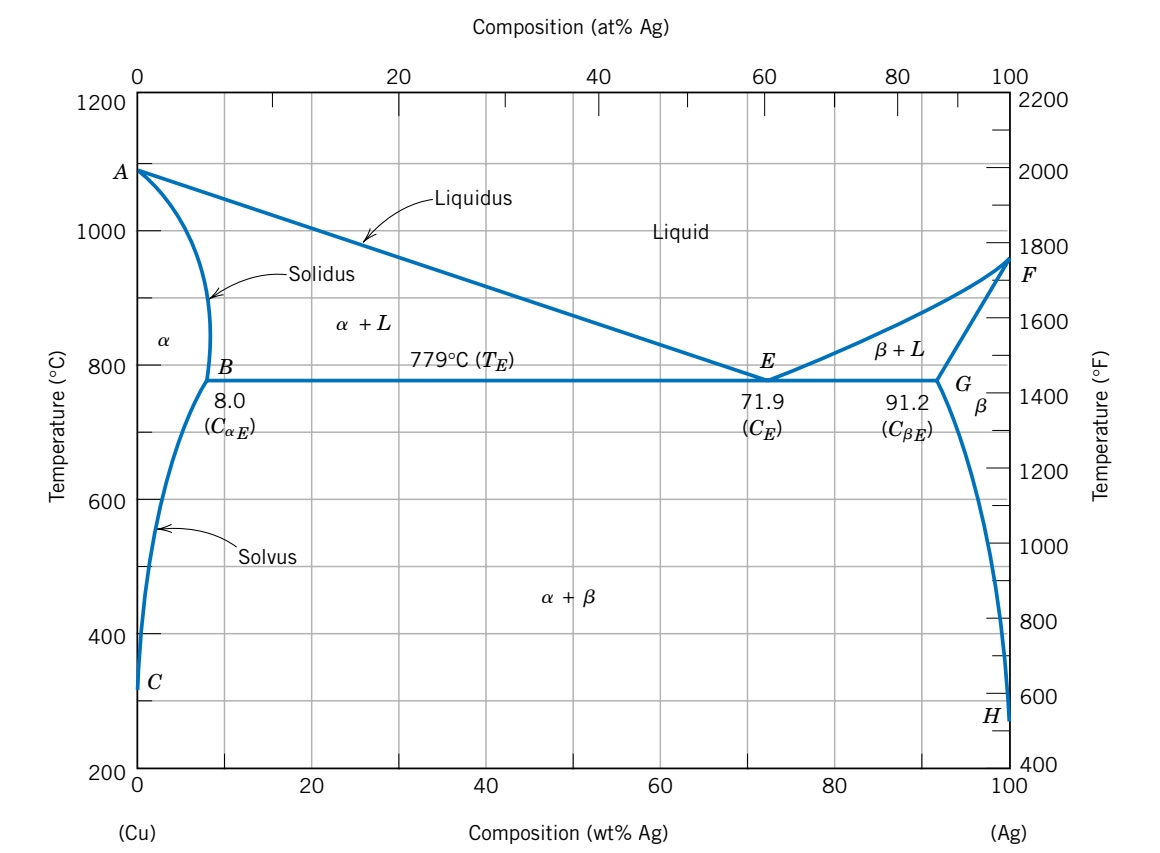
הסימונים מייצגים:
- הסימון
היא תמיסה מוצקה - אטומי בתוך סריג של אטומי . המבנה הגבישי של זהה למבנה הגבישי של . - הסימון
היא גם תמיסה מוצקה - אטומי בתוך סריג של אטומי . גם כאן המבנה הגבישי של זהה למבנה הגבישי של . - גבול המסיסות - הריכוז המרבי של מומס שניתן להוסיף לפאזה הממיסה מבלי ליצור פאזה חדשה. גבול המסיסות של
ב- מסומן ב- , וגבול המסיסות של ב- מסומן ב- .
בנוסף, חוץ מקו הסולידוס וקו הליקווידוס, נוסף קו הסוליבוס (solvus) - הקו המפריד בגבול המסיסות בין שני האזורים המוצקים
ומה קורה בנקודה
נוסחה:
למשל עבור המערכת נחושת-כסף:
מיקרומבנים
תלוי בהרכב, מבנים שונים אפשריים לקירור האיטי של הסגסוגות. ניקח דיאגרמת פאזות של בדיל-עופרת ונביט בישר האנכי המתאר את ההרכב
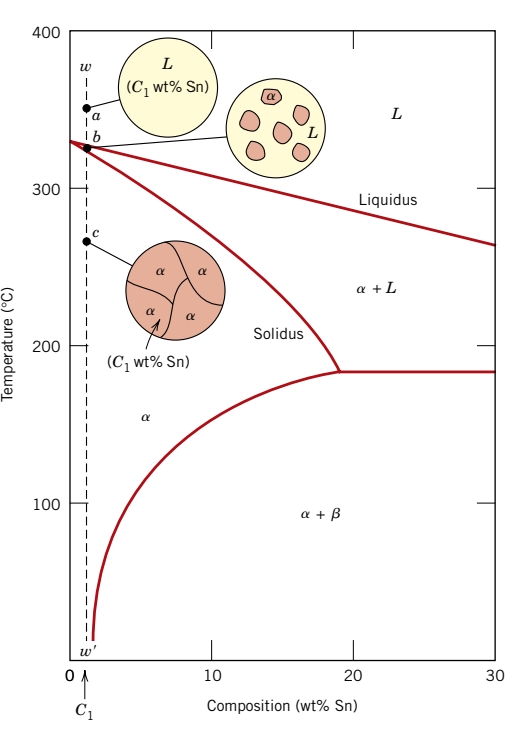
ככל שמקררים את הסגסוגת מ-
נביט כעת בקו אנכי טיפה יותר ימינה -
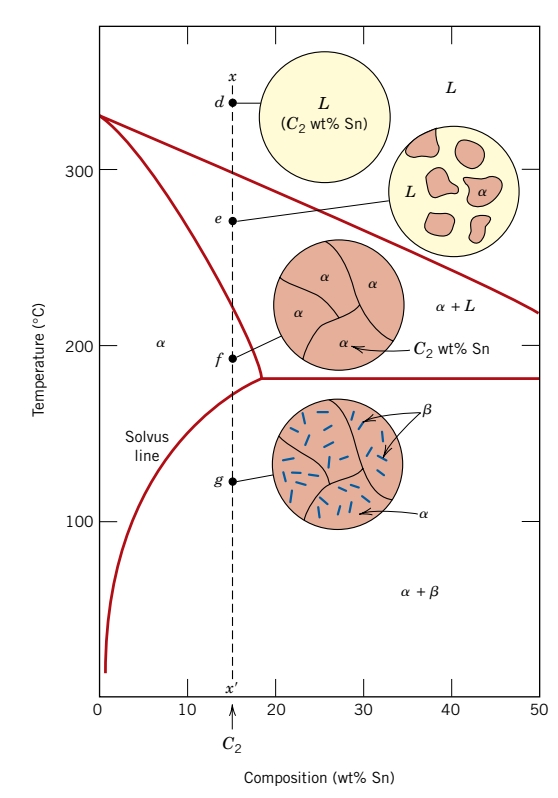
קיבלנו תוצאה ממש דומה, אבל לעומת
נביט כעת במקרה המיוחד -
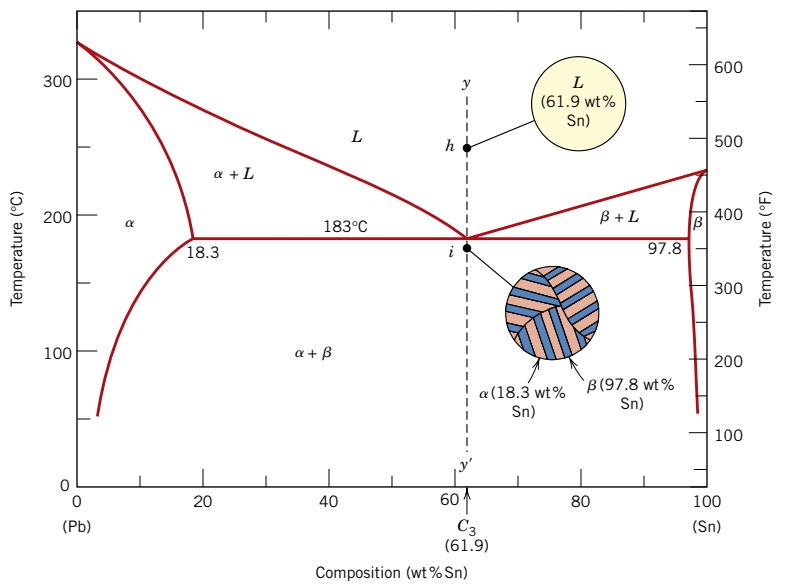
במקרה זה, ככל שהטמפרטורה יורדת, אין שום שינוי במבנה עד שמגיעים לטמפרטורה האוטקטית
כתוצאה מהתגובה נוצר מבנה מוצק הבנוי משכבות מתחלפות של
השינוי במבנה המלווה את הטרנספורמציה האוטקטית מוצגת בשרטוט הבא:
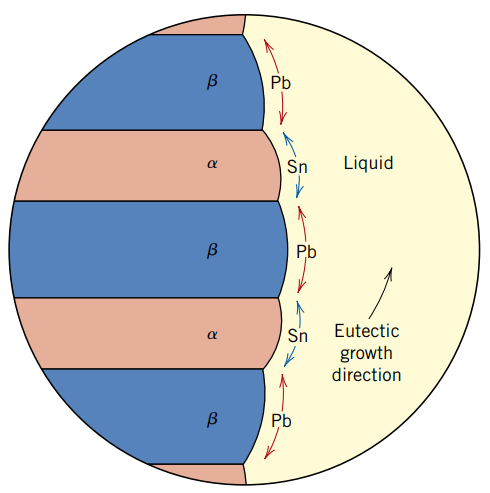
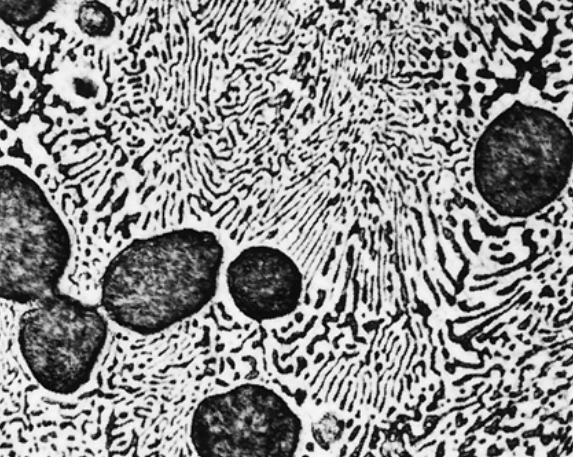
ניתן לראות את את האוטקט
אבל איך זה באמת נראה???
האזורים השחורים הם בפאזתעשירה בעופרת, והאזורים הלבנים הם בפאזת עשירה בבדיל.
המקרה האחרון שנדון בו (נסמנו
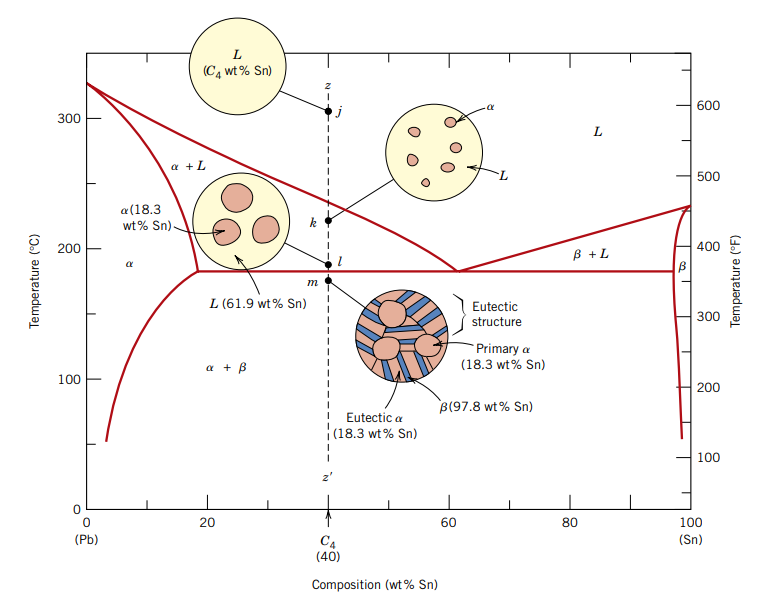
עד הנקודה
ומה עם זה?? איך זה נראה???
שיואו איזה קרציה.
ניתוח הדיאגרמה
- את ההרכב של פאזה מסויימת מוצאים באמצעות איזותרמה (כמו בדיאגרמת פאזות במסיסות מלאה), ועל ידי חיתוך עם קו הליקווידוס, הסולידוס או הסוליבוס הרלוונטיים.
- את ההרכב של מבנה מסויים מוצאים ע”י איזותרמה בטמפרטורת היווצרות המבנה.
- כמות יחסית של פאזות באזור דו-פאזי מחושבת לפי חוק המנוף בטמפרטורה של הדגם, כמו במסיסות מלאה.
- כמות יחסית של מבנה מחושבת לפי חוק המנוף, בטמפרטורה האוטקטית (
): תרגילים:
- נתונה דיאגרמת הפרזות של המערכת קדמיום-עופרת (
).
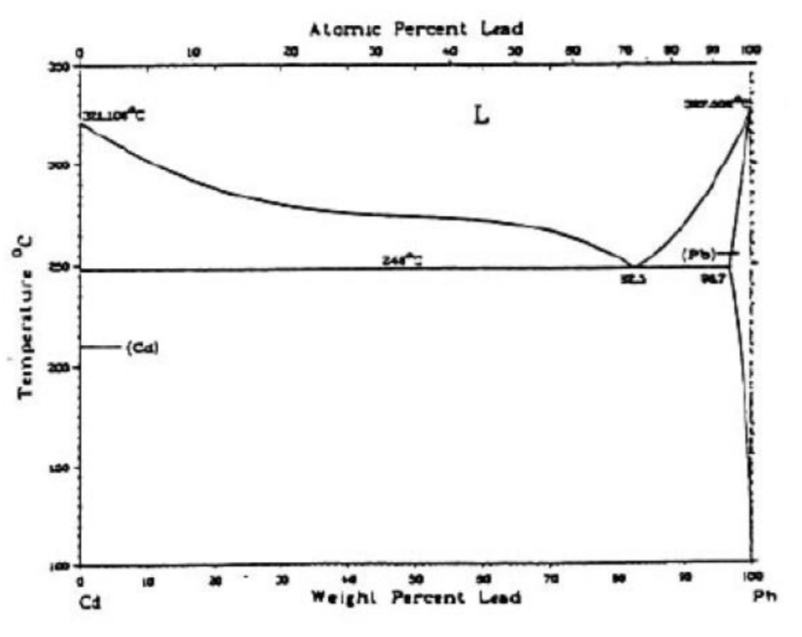
עבור נתך המכיל: - אלו פאזות מכיל נתך זה בטמפרטורה של
?
פתרון:
נכון הגרף בחרא של רזולוציה אז סמכו עליי:
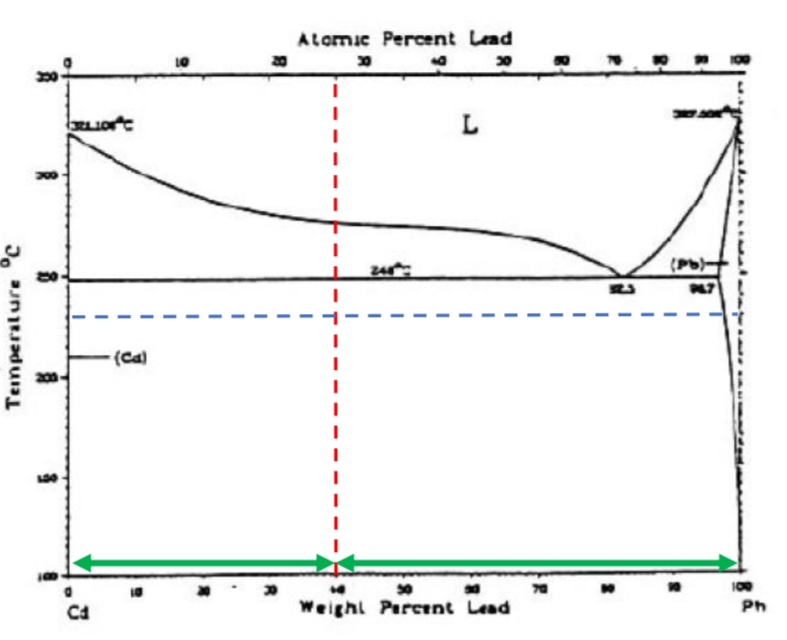
לאחר שרטוט קו הנתח והאיזותרמה, נשים לב כי יש לנו נקודות חיתוך עם קו הסולידוס של(תמיסה מוצקה של עופרת עם מעט קדמיום), ועם קדמיום טהור - , ולכן אלו הם הפאזות. - מהי הכמות היחסית של פאזה (
) בטמפ’ החדר?
פתרון:
נעביר איזותרמה בטמפ’ החדר ונקבל:
כעת לפי חוק המנוף: - מהי הכמות היחסית של המבנה האוקטטי בטמפ’ זו?
פתרון:
נביט באיזותרמה בטמפרטורת האוטקט ונשים לב כי:
לפי חוק המנוף: - מהי הכמות היחסית של פאזה (
- אלו פאזות מכיל נתך זה בטמפרטורה של