חומצות ובסיסים
חומצות ובסיסים מהווים את אחת מאבני הפינה של החיים על כדור הארץ. רוב התרכובות הביולוגיות מתפקדות כחומצות ובסיסים או מושפעות מהם.
כימאים הגדירו חומרים כחומצות ובסיסים כבר תקופה ארוכה. הכימאי הצרפתי אנטואן לבואזיה (1743-1794), היה הראשון שניסה להבין מה גורם לחומר להתנהג כחומצה. הוא הציע ב-1777, כי כדי שחומר יתנהג כחומצה, הכרחי שהוא יכיל חמצן.
כעבור 30 שנה הראה האמפרי דייווי (1778-1829) כי מימן כלורי (
הגדרה לפי ארהניוס
ב-1884 ארהניוס הציע את ההגדרה הבאה:
חומצה - חומר אשר משחרר יוני מימן,
בסיס - חומר אשר משחרר יוני הידרוקסיד,
דוגמאות:
דוגמאות של חומצות:
דוגמאות של בסיסים:
הבעיה עם ההגדרה של ארהניוס היא שעל כל הבסיסים להכיל יוני
הגדרה לפי ברונסטד ולאורי
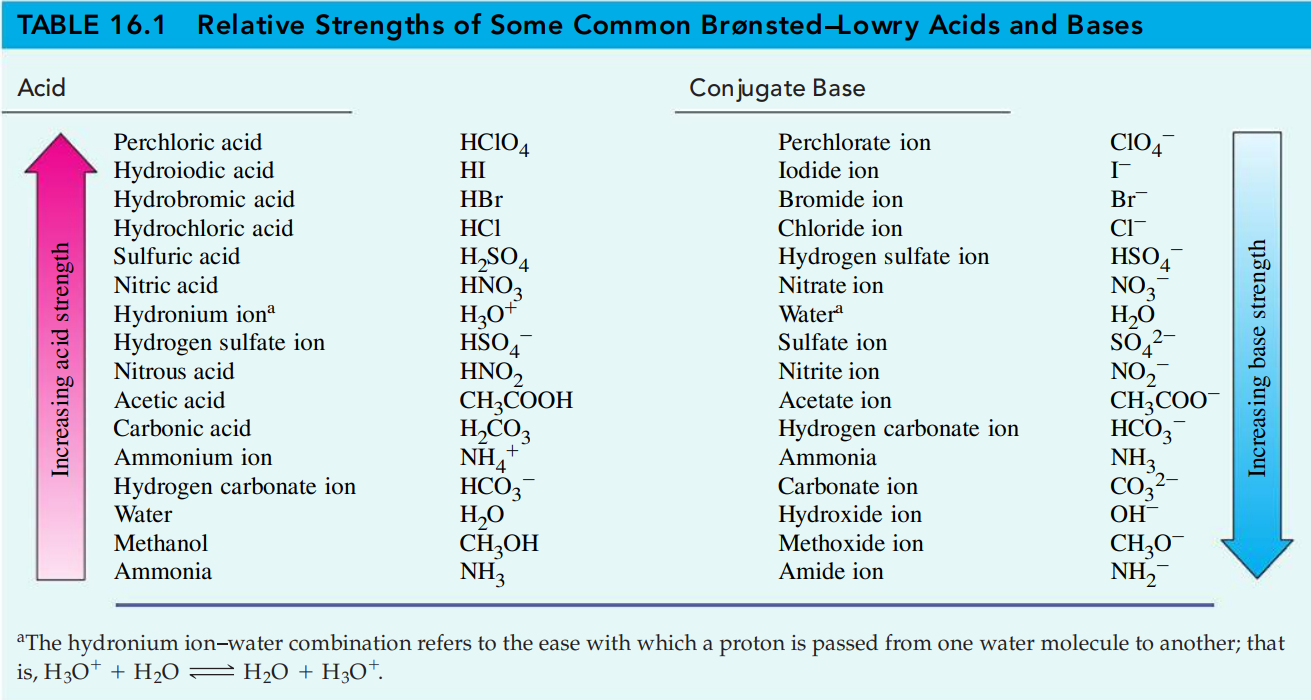
הגדרה כללית יותר לחומצות לפי ברונסטד ולאורי:
חומצה - חומר אשר תורם פרוטונים.
בסיס - חומר אשר קולט פרוטונים.
הגדרה זו מכילה את הגדרת ארהניוס - ובנוסף מגדירה בסיסים שלא נכללו לפני כן ע”י ארנהיוס.
ההבדל המהותי בין שתי ההגדרות הוא, שלפי ארהניוס ישנו מגיב אחד אשר מתפרק ליצירת מספר תוצרים.
לעומת זאת על פי ברונסטד ולאורי, במערכת “חומצה-בסיס” חייבים להיות שני מגיבים:
החומצה מוסרת פרוטון, לכן חייב להיות מישהו שיקבל את הפרוטון - הבסיס.
הבסיס מקבל פרוטון, לכן חייב להיות מי שימסודר לו את הפרוטון - החומצה.
כלומר, במערכות חומצה ובסיס חייבים להיות נוכחים גם חומצה וגם בסיס.
ניקח את הבסיס הבעייתי לפי ארהניוס,
כעת, המים,
חומצה חזקה
כאשר מוסיפים חומצה למים, היא מוסרת למים פרוטון (המים משמשים למעשה כבסיס). בעקבות כך נוצר יון הידרוניום,
רישום מלא:
רישום מקוצר:
זוג האלקטרונים הבלתי קושר של אטום החמצן במולקולת המים משמש לקליטת הפרוטון מהחומצה, וכתוצאה מכך החומצה (או מה שנשאר ממנה) הופכת לאניון:
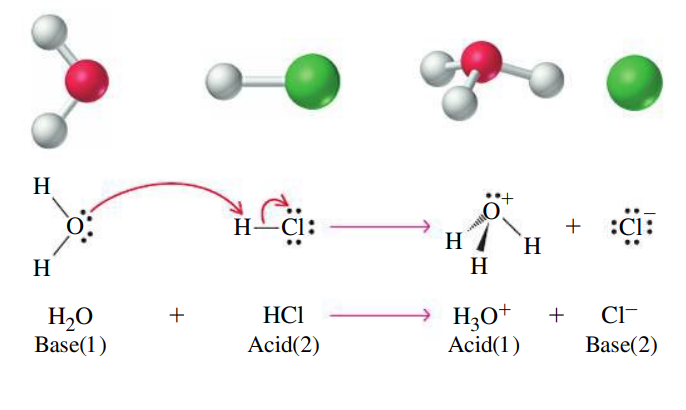
החומצה
חומצה חלשה
חומצה אצטית היא חומצה חלשה אשר מתפרקת ליונים באופן חלקי (ולא סטויכיומטרי). הבדל זה בא לידי ביטוי בכך שעבור חומצה חלשה נכתוב משוואת תגובה בשיווי משקל:
גם כאן, זוג האלקטרונים הבלתי קושר של אטום החמצן במולקולת המים משמש לקליטת הפרוטון מהחומצה וכתוצאה מכך החומצה הופכת לאניון:
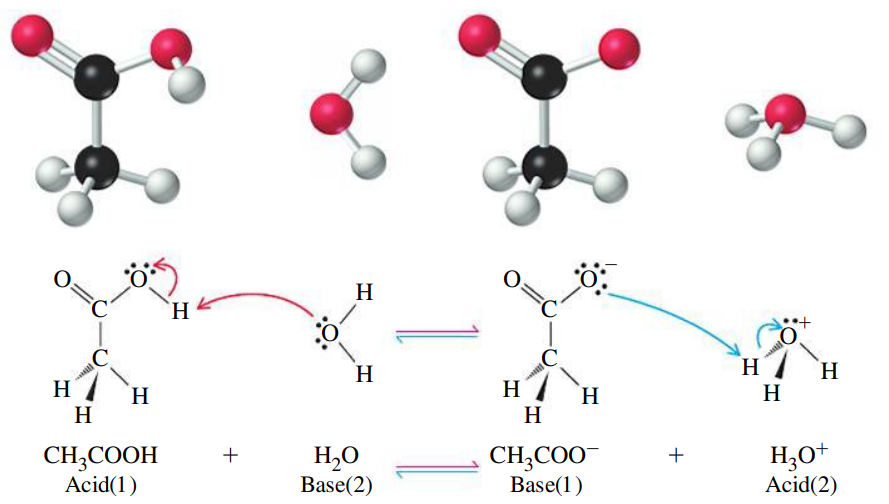
נשים לב שברישום המקוצר:
כיוון שלא רושמים את
הגדרת
כמו בכל תגובת שיווי משקל, ישנו קבוע שיווי משקל. עבור חומצות הוא לא כל כך שונה. למשל עבור:
נכתוב ביטוי עבור קבוע ש”מ של פירוק החומצה:
המים הם נוזל טהור, אשר אינו נכלל בביטוי של קבוע ש”מ. (אנו מתחייסים לתמיסות מהולות, ולכן כמות מולקולות החומצה והיונים הנוצרים קטנה בהרבה מכמות מולקולות המים).
ככל ש-
בסיס חזק
בסיסים חזקים הם לרוב מלחים של מתכות עם יוני הידרוקסיד
בסיס חלש
בבסיס חלש, המים משמשים למעשה כחומצה. בעקבות מעבר הפרוטון מהמים לבסיס, נוצר יון הידרוקסיד
במקרה זה, זוג האלקטרונים הבלתי קושר של החנקן במולקולת האמוניה “תולש” פרוטון מהמים, וכתוצאה מכך הבסיס הופך לקטיון:
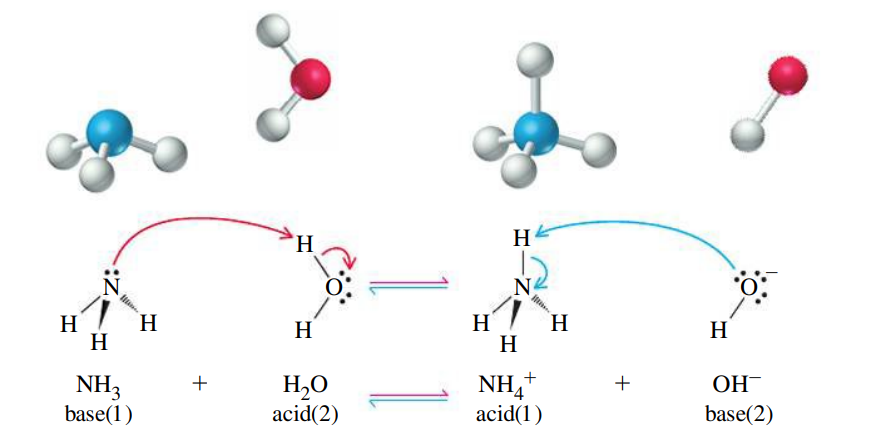
הגדרת
נוכל לכתוב קבוע ש”מ עבור בסיסים חלשים. למשל עבור אמוניה:
כמו בחומצה, ככל ש-
הערות:
- הערך הזהה של קבוע פירוק של חומצה אצטית לזה של אמוניה הוא מקרי לחלוטין
הפירוק העצמי של מים
מים מזוקקים מוליכים זרם חשמלי במידה מועטה מאוד, אף על פי שאינם מכילים יונים בכלל. מוליכות חלשה זו נובעת מנוכחותם של כמות מזערית של יוני הידרוניום (
מקורם של יונים אלה הוא בתגובה בין שתי מולקולות מים, אשר אחת משמשת כחומצה והשנייה כבסיס:
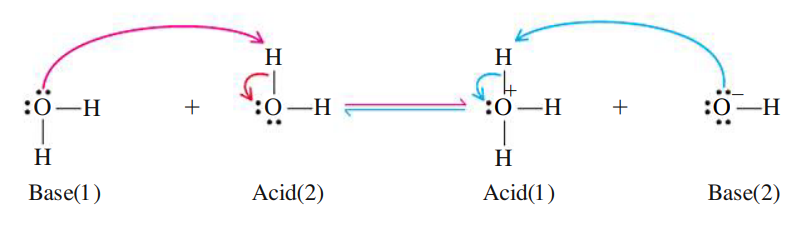
מדדו את מוליכות המים המזוקקים והסיקו מכך את קבוע הש”מ:
קבוע שיווי משקל זה נקרא קבוע הפירוק של המים (
כפי שניתן לראות ע”פ ערכו של הקבוע, תגובת הפירוק של המים היא זניחה, כלומר נוצרים מעט מאוד יונים בתמיסה.
כמות יוני ההידרוניום וההידרוקסיד במים טהורים שווה (סטויכיומטריה 1:1), ולכן:
בכל תמיסה מימית, מכפלת הריכוזים של יוני ההידרוניום וההידרוקסיד תהיה שווה לקבוע הפירוק של המים,
חומצה ובסיס צמודים
בכדי שחומר המוגדר חומצה יוכל למסור פרוטון הוא חייב להכיל פרוטון.
בכדי שחומר המוגדר בסיס יוכל לקבל פרוטון, הוא חייב להכיל זוג אלקטרונים בלתי קושר, שאליו הפרוטון יקשר. לאחר שהחומצה מסרה פרוטון היא נותרת עם זוג אלקטרונים בלתי קושר. לאחר שהבסיס מקבל פרוטון, הוא “מחזיק” פרוטון. נדגים עם אמוניה:
נשים לב כי יש קשר בין
גם הזוג
היחס בין
נחבר תגובה כללית של חומצה לתגובה של הבסיס המצומדים אליה:
נקבל כי:
דוגמאות:
- ראינו קודם שקבוע ש”מ עבור אמוניה הוא:
נוכל כעת לפי הקשר שמצאנו בין הקבועים למצוא את קבוע ש”מ של החומצה המצומדת של אמוניה:
כעת נוכל לחלץ את
:
נוכל להסיק מכך שככל שחומצה חזקה יותר, כך הבסיס המצומד שלה חלש יותר. ככל שבסיס חזק יותר כך החומצה המצומדת שלו חלשה יותר.
ניתן לחשוב על זה כך: ככל שחומצה חזקה יותר, כך התגובה נוטה יותר לכיוון התוצרים, כלומר התוצרים פחות “רוצים” לחזור להיות המגיבים - הבסיס הצמוד פחות “רוצה” לחזור להיות חומצה, ולכן הוא חלש יותר.
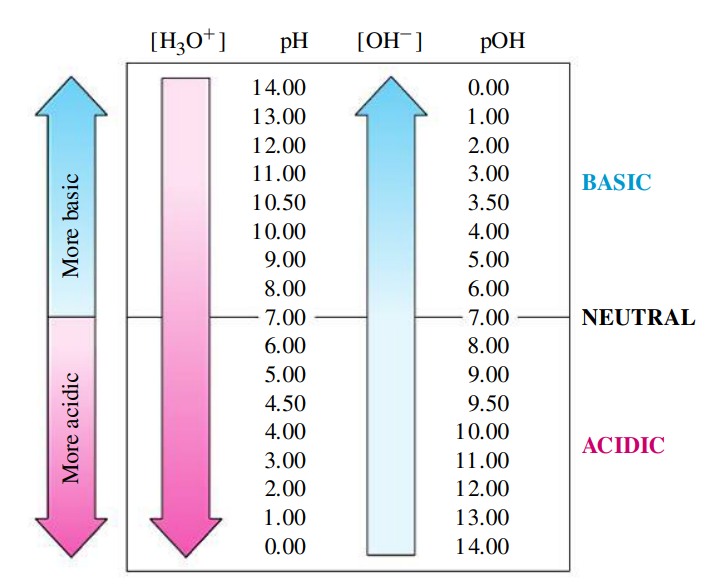
פונקציית ה-
ברוב המקרים, ריכוזי החומצה והבסיס שנעבוד איתם יהיו נמוכים מאוד. (כמו שניתן לראות גם מריכוזי יוני ההידרוניום וההידרוקסיד במים נייטרליים).
לכן מטעמי נוחות מגדירים שתי פונקציות חדשות:
דוגמאות:
- מה יהיה ה-
של תמיסת חומצת בריכוז ?
מדובר בחומצה שמתפרקת במלואה - חומצה חזקה:לכן:
בגלל שמכפלת ריכוזי היונים בתמיסה מימית היא קבועה, מתקיים גם קשר קבוע בין
עבור מים ניטרלים,
תמיסה חומצית מאופיינת בעודף יוני הידרוניום, ולכן בעלת
תמיסה בסיסית מאופיינת בעודף יוני הידרוקסיד, ולכן בעלת
תגובת סתירה
מה יקרה אם נשלב תמיסה חומצית ותמיסה בסיסית?
אם נשלב כמות מסוימת של חומצה ובסיס נקבל מצב בו אין בתמיסה לא יוני הידרוניום ולא יוני הידרוקסיד ולכן התמיסה תחשב כנייטרלרית. תגובה כזו נקראת תגובה סתירה ותוצריה הם מלח (מומס בד”כ) ומים. למשל:
תגובת הסתירה מתרחשת בין יוני ההידרוניום וההידרוקסיד אשר מנטרלים אחד את השני ליצירת מולקולת מים, בעוד שיוני הכלור והנתרן אינם משתתפים בתגובה.
ה-
כאשר מלח נתרן כלורי
לעומת זאת, כאשר המלח אמוניום כלוריד (
הטענה היא שמתקיים
ואכן אנו מקבלים
ואכן קיבלנו כי נוצרים