מבנים רזונטיביים
בתיאור הקשר הכימי בין שני יסודות עד כה, הנחנו כי האלקטרונים האחרים ליצירת קשר זה מאותרים. כלומר, אורביטלי הקשר ממוקמים בין שני האטומים. אך ישנם מקרים בהם הנחה זו אינה תואמת את המציאות כפי שבא לידי ביטוי בניסויים המצביעים על כך.
לדוגמה, נבחן את המבנה לואיס עבור מולקולת אוזון

קיבלנו שתי אפשרויות.
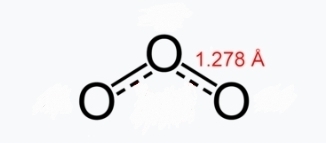
בכל צורה קיים קשר בודד וקשר כפול אחד, אך ממדידות ניסיוניות (ספקטרוסקופיה), אנו יודעים שני הקשרים במולקולת האוזון זהים באורכם ושווים ל-
נוכל לפתור את קיום שתי אפשרויות אלו, בלקבוע שמבנה לואיס האמיתי של
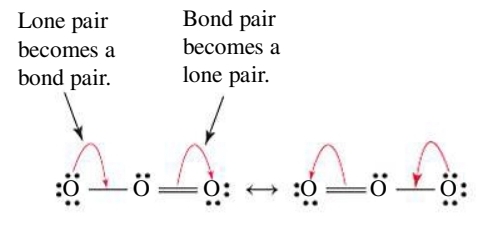
סיטואציה בה יש שניים או יותר מבני לואיס התורמים למבנה “נכון” נקרא רזוננס.
חשוב להבין כי תיאור זה אינו מציין מעבר או תנודה של המולקולה מצורה אחת לשנייה. קיימת רק צורה אחת ויחידה של מולקולת אוזון ובה שני קשרי חמצן-חמצן שווים זה לזה. לכן, קיימת הצגה בודדת המתארת בצורה טובה יותר הרזוננס:
כל הצורות הרזונטיביות חייבות להופיע עם אותו שלד מולקולרי (מיקום האטומים לא משתנה) אך עם פילוג אלקטרונים שונה. לא כל הצורות הרזונטיביות חייבות לתרום באופן זהה למבנה רזונטיבי נתון. לדוגמה, עבור אניון האזיד (
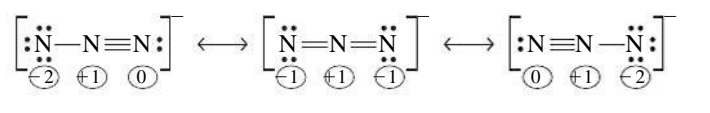
משיקולים של מטען פורמלי, הצורה המרכזית היא הסבירה ביותר כי היא נושאת מטען פורמלי של
המבנה המרחבי של מולקולות
מבני לואיס לא נותנים לנו מידע על כיצד המולקולה נראית במרחב. למשל, מבנה לואיס של מים:
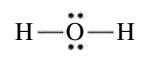
לפי איך שציירנו את מבנה לואיס זה, אנו יכולים בטעות לחשוב שפיזית, אטומי החמצן והימין במולקולה
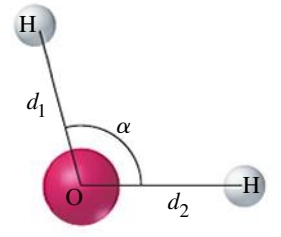
לעיקום זה משמעות רבה. למשל, במים, הצורה של המולקולה מסבירה מדוע מים נמצאים במצב צבירה נוזלי ולא גזי בטמפרטורת החדר.
לחומרים רבים אותו הרכב כימי אך תכונות כימיות, פיזיקליות, מכאניות שונות. למשל לפחמן צורות רבות, אלוטרופים, בטבע: גרפיט (החונר ממנו עשוי חוד עיפרון), יהלום ועוד. הם כולם מורכבים מאוטו היסוד,
כדי שנוכל להתחיל להסביר ולתאר את המבנה המרחבי של המולקולות, נגדיר גדלים חדשים:
- אורך הקשר - המרחק הממוצע בין שני מרגזי גרעיניהם של שני אטומים קשורים.
- זווית הקשר - הזווית הממוצעת בין שני קווים דמיוניים המקשרים את האטום המרכזי עם שני האטומים משני צדיו.
מודל VSEPR
Valence Shell Electron-Pair Repulsion
מודל המשמש לניבוי המבנה הגיאומטרי של מולקולות.
זוגות אלקטרונים דוחים אחד את השני, בין אם הם בקשרים כימיים או לא משותפים בין אלקטרונים (זוגות בודדים/גלמודים). הם מסתדרים כך שהדחייה בינהם תהיה מינימלית - במילים אחרות, שהם יהיו במרחק מקסימלי אחד מהשני.
במודל VSEPR אנו מחלקים את המולקולה לקבוצות אלקטרונים, ונעזרים במבנה לואיס כדי לעשות זאת. חלוקה זו נעשית כך:
- מתמיר - אטום הקשור ישירות לאטום המרכזי, בקשר בודד כפול או משולש.
- זוג גלמוד (זוג אלקטרונים לא קושר).
למשל, במולקולת:
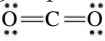
לאטום הפחמן המרכזי יש 2 קבוצות אלקטרונים - כל אחד מהקשרים הכפולים.
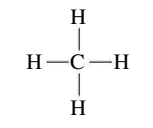
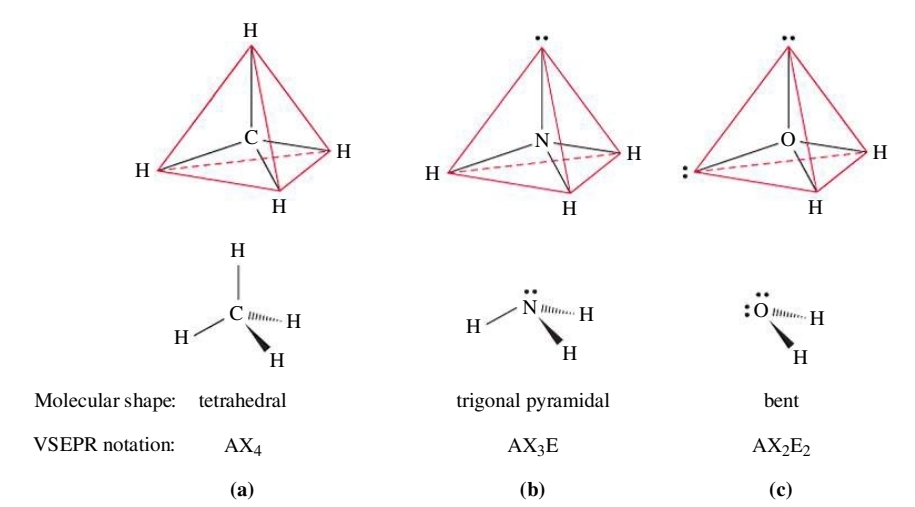
עבור מולקולת המתאן, לאטום המרכזי יש 4 קבוצות אלקטרונים:
כיצד הם יסדרו את עצמם במרחב התלת ממדי? התשובה היא בצורת טטרהדר:
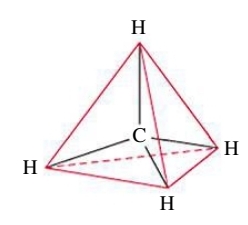
מדוע? כי זוהי הצורה בה כל 4 קבוצות האלקטרונים נמצאים במרחק מקסימלי אחד מהשני.
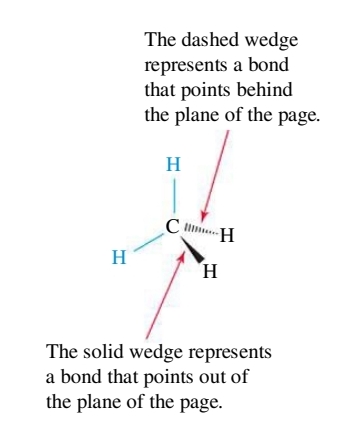
לרוב כדי להדגיש את התלת ממדיות של מולקולה על דף, נבחר קבוצות אלקטרונים שנמצאים במישור הנייר, ולפיהם נצייר את קבוצות האלקטרונים ש-”מאחורי” הנייר, ו-”מלפני” הנייר:
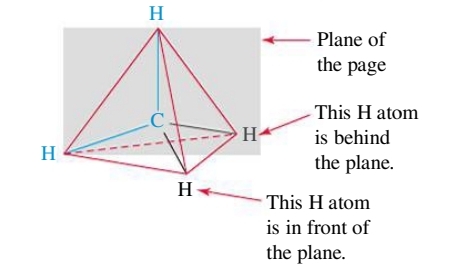
ונסכם זאת בשרטוט הסופי:
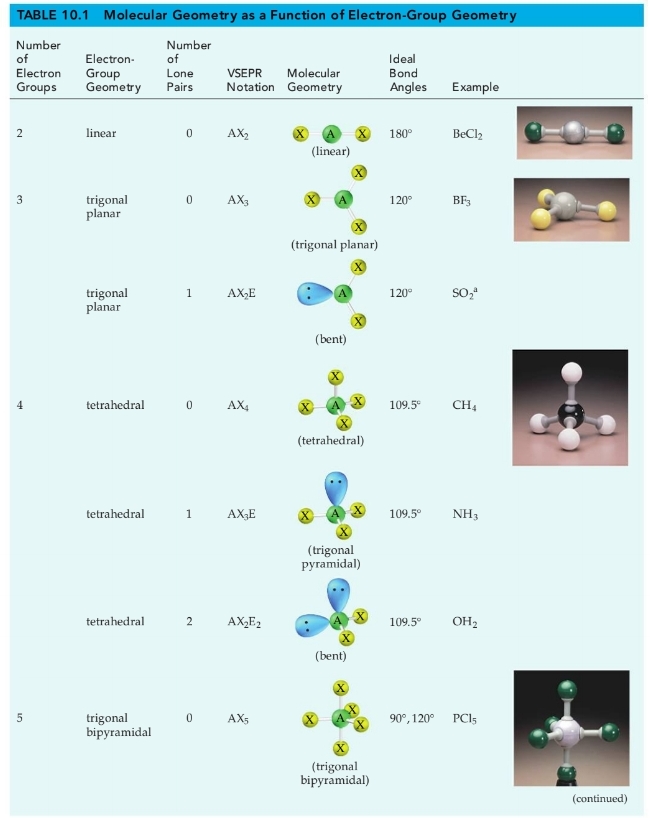
אם נסתכל עוד מבנים בעלי מתמירים זהים, נקבל מבנים אידיאליים, ולפי מספר קבוצות האלקטרונים, נקבל את הצורת הבאות:
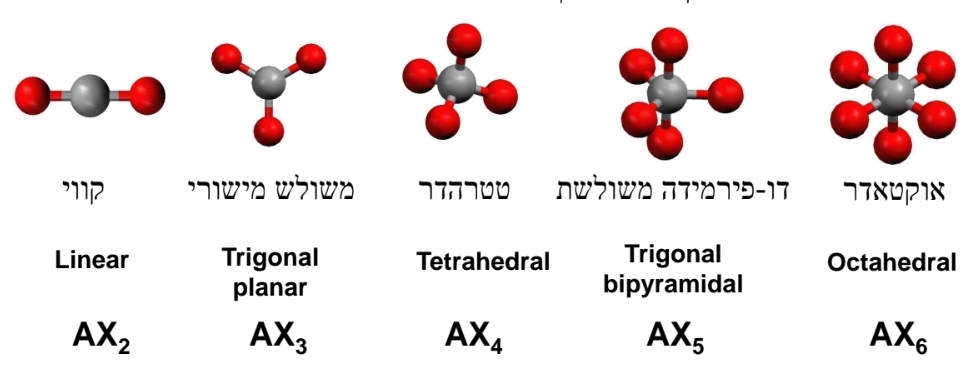
כאשר
במבנים אידיאליים אלו ישנם זוויות אידיאליות.
אבל מה אם קבוצות האלקטרונים לא זהים? למשל עבור מולקולת המים,
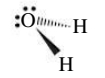
נשים לב ששתי זוגות האלקטרונים בשרטוט זה על מישור הנייר לעומת המתמירים
דוגמאות נוספות:
מומנט דיפול
במולקולת
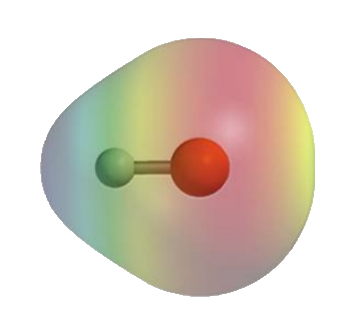
מולקולה זו היא מולקולה פולארית. נשתמש בחץ בכיוון האטום שמושך יותר אלקטרונים כדי לתאר זאת:

גודל השינוי במטען החשמלי בקשר קוולנטי פולארי נתון ע”י המומנט דיפול, (
אם למכפלה זו יש גודל של
הפולאריות של קשר
נוכל לחשב את המטען החלקי הזה ע”י מומנט הדיפול שנמדד עבור קשר זה,
מטען זה הוא בערך
דוגמאות נוספות למומנט דיפול של מולקולות שונות:
- המולקולה
היא לא פולארית. כדי להסביר את זה אנו צריכים לבצע הפרדה בין הפולאריות של קשרים מסוימים במולקולה, לבין הפולאריות של המולקולה כולה. הפרש האלקטרושליליות בין ל- יוצרת הזזה של מטען אלקטרוני לכיוון אטום ה- בכל קשר חמצן-פחמן, ובכך יוצרת מומנט דיפול. אבל, כיוון ששני הקשרים בעלי מומנט דיפול שווה ומנוגד בכיוונו, הם מקזזים אחד את השני ובכך יוצרים מומנט דיפול אפסי:
- מולקולת מים,
היא פולארית. לקשרים שלה יש מומנט דיפול בגלל הפרשי האלקטרושליליות, ובגלל המודל VSEPR של מים, שהוא עקום, המומנט דיפול של שני הקשרים האלה אומנם שווים בגודלם אך הם נמצאים בזווית:
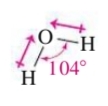
ולכן המומנט דיפול המשולב של שני קשרים אלו הוא.
