מצב הצבירה גז
חומר במצב צבירה גזי מתאפיין בתכונות הבאות:
- צפיפות נמוכה
- דחיסות גבוהה
- מפעיל לחץ על הסביבה
- תופס את כל הנפח הזמין לו במערכת
במול אחד של גז (הנמצא בטמפרטורה של
גז אידיאלי ולא אידיאלי
בפיזיקה בשיעורים הראשונים אוהבים לומר “ניתן להזניח חיכוך”. ברור לנו שאין באמת דבר כזה משטח ללא חיכוך, אבל אנו אומרים זאת או כי חיכוך זה לא משהו שאנו רוצים להתרכז בו באותו הרגע, או כי המשטח מספיק קרוב להיות כמו משטח ללא חיכוך, כך שהחיכוך באמת זניח.
כמו כן בכימיה, המציאו את המושג גז אידיאלי כדי לתאר גז שאין בו אינטראקציה בין אטומי הגז (אין כוחות דחייה או משיכה), וכי נפח המולקולות/אטומים זניח יחסית לגודל המערכת. כמו כן, גז אידיאלי לעולם לא מתנזל.
ברור לנו כי גז כזה לא באמת קיים, אך יש גזים שממש דומים לגז אידיאלי (גזים אצילים בעיקר), ולכן נשתמש במושג זה כדי להסביר תופעות יותר מסובכות המתרחשות בגזים.
לחץ
לחץ, (מסומן ב-
ברומטר
ב-1643, אוונג’ליסטה טוריצ’לי (1608-1647), בנה מכשיר למדידת הכוח שמופעל ע”י האטמוספרה. מכשיר זה נקרא ברומטר:
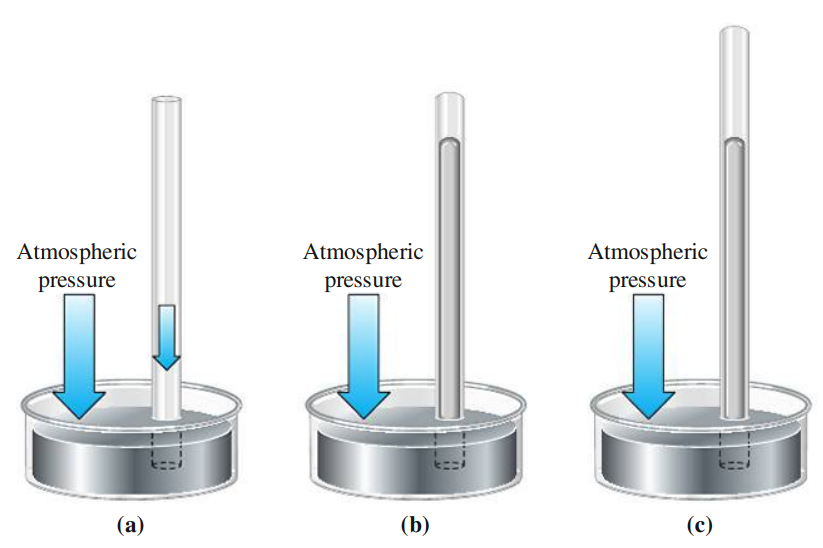
כאשר לוקחים צינור פתוח ומעמידים אותו בכלי שטוח של נוזל, לרוב כספית, גובה הנוזל בכלי ובצינור שווים (
אם נמלא את הצינור בנוזל ונסגור אותו בחלקו העליון, נצפה שנחזור לסיטואציה בה היינו ב-
אם נציב את הנתונים בהגדרה של מילימטר כספית בהגדרת הפסקל, נקבל:
יחידת מידה נוספת היא:
חוקי הגז הפשוטים
חוק בויל
חוק בויל קובע כי נפחו של כמות מסוימת של גז נמצא ביחס הפוך ללחצו, בתנאים של טמפרטורה קבועה. תהליכים המתרחשים בטמפרטורה קבועה נקראים תהליכים איזותרמיים.
דוגמאות:
- מערכת נסיונית נמצאת בלחץ של
אטמוספרה ומכילה ליטר אוויר. איזה לחץ יש להפעיל כדי לדחוס אותה לנפח של ליטר באותה טמפרטורה?
פתרון:
נתון:לפי חוק בויל:
חוק שארל
ז’אק שארל הראה כי עבור כל שינוי בטמפרטורה של
כאשר
דוגמאות:
- כדור פורח מולא בגז הליום בנפח של
ובטמפרטורה של . כבור מספר ימים הטמפרטורה ירדה ל- , באותו לחץ. מהו הנפח החדש של הכדור?
פתרון:לפי חוק שארל:
חוק אבוגדרו
חוק אבוגדרו קובע כי בלחץ וטמפרטורה קבועים, מספר המולים של גז כלשהו תלוי בנפח הדוגמא, אך לא בסוג הגז. כלומר, נפחים שווים של גזים שונים הנמצאים באותם תנאי לחץ וטמפרטורה מכילים מספר מולקולות שווה.
משוואת הגז האידיאלי
אם נשלב את כל שלושת החוקים, ובעזרת ניסויים נחשב את אותו הקבוע המופיע בכל משוואה, נקבל:
כאשר
תנאים תקינים ותנאי סביבה תקינים
נפחו של גז משתנה בהתאם ללחץ והטמפרטורה שלו, לכן נוח לבחור תנאים סטנדרטיים מסומים כתנאים בהם נוכל להשוות את הנפחים של הגזים השונים. באופן שרירותי נבחרו לחץ של
חוק הלחצים החלקיים של דלטון
הלחץ הכולל בתערובת של גזים שווה לסכום הלחצים החלקיים של כל הגזים בתערובת.
תיאור מיקרוסקופי של לחץ
תזכורת:
האנרגיה הקינטית הממוצעת של גז כלשהו נתונה ע”י:
אם נרצה לחשב את האנרגיה של אטום/מולקולה בודדת:
כאשר: