האטום
חומר
חומר הוא כל דבר שיש לו מסה ותופס נפח במרחב. כל החפצים שאנו סביבנו עשויים מחומרים. הגזים באטמוספרה, אף שהם בלתי נראים, הם חומר - הם תופסים מקום במרחב והם בעלי מסה. אור שמש הוא לא חומר, אלא סוג של אנרגיה.
אטום
ג’ון דלתון פיתח את מה שידוע כיום כהמודל האטומי, בהם הוא קבע כי:
כל יסוד כימי מורכב מחלקיקים זעירים לא ניתנים לפירוק הנקראים אטומים. אטומים לא יכולים להיווצר או להיהרס בזמן שינוי כימי.
לפי הנחה זו, אותם האטומים שמופיעים לפני תגובה כימית חייבים להימצא גם לאחר מכן.
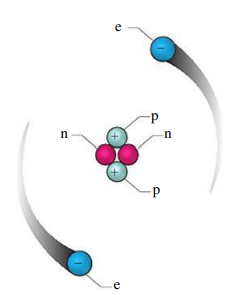
האטום מורכב מצירוף מסוים של פרוטונים, ניוטרונים ואלקטרונים. במרכז האטום נמצא הגרעין שהוא בעצמו מורכב מפרוטונים בעלי מטען חיובי (
מסת הפרוטון
מסת האלקטרון
מבחינת גודל הגרעין - אם האטום היה בגודל חדר
יסוד כימי
לכל אטום מאותו יסוד כימי יש את אותו מספר הפרוטונים. לכן לפי מספר זה, הנקרא המספר האטומי נוכל להבדילו בין יסודות שונים:
כאשר:
- הסמל
הוא סמל היסוד (במקרה זה, פחמן). - הסימון
הוא המספר האטומי. - הסימון
הוא מספר המסה.
מספר מסה הוא מספר הפרוטונים + מספר הניטרונים ביסוד (מספר הניוטרונים לא תמיד שווה למספר הפרוטונים).
איזוטופ - אטומים השונים של אותו יסוד בעלי אותו מספר אטומי, אך בעלי מסה שונה (מספר ניטורונים שונה) נקראים איזוטופים של אותו האטום. למשל, שניים מהאיזוטופים השונים של אותו היסוד:
יון הוא אטום בעל מספר אלקטרונים שונה ממספר הפרוטונים ולכן הם אינם ניטרלים ונושאי מטען. למשל:
זהו אטום חמצן עם
הערות:
את המטען של האטום תמיד מסמנים עם גודל המטען ומימינו סימן המטען.
משקל אטומי
משקל אטומי
כאשר
מול
מול הוא יחידה כמותית. כלומר, אפשר לומר “יש לי מול של בקבוקים” או “בתוך הצנצנת יש מול של גרגירי חול”. הגדירו למול את הגודל
אז למה המספר הענקי והמסוים הזה? מהסיבה שכאשר אנו מדברים על מספר אטומים בגרם של חומר מסוים, הרבה יותר נוח לומר “יש לי 0.5 מול של פחמן” מאשר “יש לי
גודל המול מוגדר ככמות האטומים שיש ב-
דוגמאות:
תרגילים:
- בהינתן
של גופרית ( ), כמה מולים יש בדגימה זו? כמה אטומים? נתון כי המשקל האטומי שלו הוא .
תרכובות כימיים
מים, פחמן דו-חמצני, פחמן חד חמצני הם כולם תרכובות כימיים. תרכובת כימית מוגדרת כהרכב של שני אטומים או יותר, שבינהם קשרים כימיים “המחברים” אותם. את התרכובות ניתן לייצג בעזרת נוסחאות כימיות, שמורכבות מהסימנים של היסודות הכימיים שמרכיבים אותן. נבדיל בין שתי סוגי תרכובות.
תרכובת מולקולרית
תרכובת מולקולרית מורכבת בדרך כלל מאטומים לא מתכתיים שמוחזקים ביחד ע”י קשר קוולנטי - קשר בו האטומים משתפים בינהם חלק מהאלקטרונים. את המולקולה נייצג בנוסחה כך:
סימון זה מייצג את המולקולה של מים - שני אטומי מימן
לגבי הסימון הבא:
סימון זה מייצג
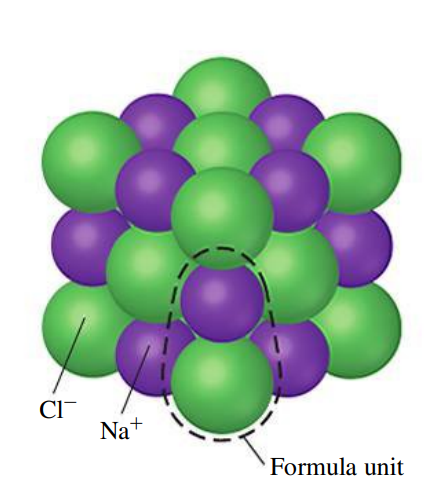
תרכובות יוניות
שילוב כימי של מתכת ואל-מתכת בדר”כ יוצר תרכובת יונית. תרכובת זו עשויה מיונים שליליים ויונים חיוביים “המחוברים” אחד לשני ע”י קשר יוני - קשר בו ישנו מעבר של אלקטרונים מאטום אחד לאטום שני.
האטומים של יסודות מתכתיים נוטים “לאבד” אלקטרון כאשר הם משולבים עם אטום אל-מתכתי. אטום חיובי זה נקרא קטיון (יון בעל מטען חיובי). לעומת זאת, האטום האל-מתכתי קולט את האלקטרון, והוא נקרא אניון (יון בעל מטען שלילי).
למשל, מלח שולחן:
נוסחאות כימיות
נוסחא אמפירית
נוסחה אמפירית היא הנוסחה הפשוטה ביותר של תרכובת. היא מראה שני דברים:
- סוג האטומים בתרכובת.
- הכמות היחסית שלהם (ביחס לאטומים אחרים).
למשל, הנוסחאהיא הנוסחא האמפירית לתרכובת .
לחומצה אצטית (), פורמלדהיד ( ) וגולקוז ( ) יש את אותה הנוסחה האמפירית.
נוסחא מולקולרית
מבוססת על המולקולה עצמה בתרכובת. המולקולה של חומצה אצטית מכילה
מסה של תרכובת
המסה המולקולרית
המסה המולרית של מולקולה היא המסה של מול אחד שלה. המסה המולקולרית של